题目内容
16.足量的氯气或盐酸分别跟下列金属反应,均有MCl2型化合物生成的是( )| A. | Al | B. | Mg | C. | Fe | D. | Na |
分析 有MCl2型化合物生成,则金属的化合价为+2价,且没有变价,以此来解答.
解答 解:A.Al与盐酸反应生成AlCl3,故A不选;
B.Mg与足量的Cl2或盐酸反应均生成MgCl2,故B选;
C.Fe与足量的Cl2反应生成FeCl3,故D不选;
D.Na与足量的Cl2或盐酸反应均生成NaCl,故D不选;
故选B.
点评 本题考查氯气的性质,为高频考点,把握金属的化合价及发生的反应为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
6.Na的离子半径和Ne的原子半径( )
| A. | 大于 | B. | 小于 | C. | 等于 | D. | 不能肯定 |
7.三草酸合铁酸钾晶体K3[Fe(C2O4)3]?3H2O可用于摄影和蓝色印刷.某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究.请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
限选试剂:浓硫酸、1.0mol•L-1HNO3、1.0mol•L-1盐酸、1.0mol•L-1NaOH、3% H2O2、0.1mol•L-1 KI、0.1mol•L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水.
(1)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3.验证固体产物中钾元素存在的方法是利用焰色反应,现象是透过蓝色钴玻璃,观察到紫色的火焰.
(2)固体产物中铁元素存在形式的探究.
①提出合理假设
假设1:全部是铁单质;
假设2:全部为FeO;
假设3:同时存在铁单质和FeO.
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验.在答题卡上按下表的格式写出实验步骤、预期现象与结论.
| 实验步骤 | 预期现象与结论 |
| 步骤1: | 部分固体不溶解 |
| 步骤2: | |
| 步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色.取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN. |
4.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
11.短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12.回答下列问题:
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1mol气态氢化物所对应的热量变化是b(选填字母编号).
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
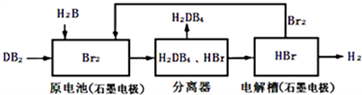
①查得:
试写出通常条件下电解槽中发生总反应的热化学方程式:2HBr(aq)=H2(g)+Br2(g)△H=+94kJ/mol
②根据资料:
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到无淡黄色沉淀产生,最终生成白色沉淀,证明分离效果较好.
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=4H++SO42-.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点有Br2被循环利用或能源循环供给或获得清洁能源(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.

①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=4H++SO42-.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点有Br2被循环利用或能源循环供给或获得清洁能源(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
6.下列各组离子在溶液中可以大量共存的是( )
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |