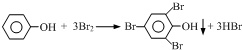
题目内容
1.化学是一门以实验为基础的学科,试回答以下问题.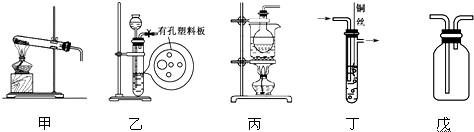
(1)选用装置甲、戊制取并收集少量氨气,氨气应从收集装置的短(填“长”或“短”)导管进气,写出利用该装置制备氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)选用装置乙、丙制备少量一氧化氮气体,乙中塑料板上若放置大理石,则装置乙的作用是利用碳酸钙与盐酸产生的CO2排尽装置中的空气,丙中产生NO的离子方程式为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.
(3)二氧化氯(ClO2)为A1级消毒剂,某研究小组利用丁装置制备ClO2.
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热.反应生成ClO2、CO2和一种酸式盐,则该反应中氧化产物与还原产物物质的量之比为1:1.
②温度过高时,二氧化氯的水溶液有可能引起爆炸.在反应开始前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是温度计.
③将二氧化氯溶液加入到硫化氢溶液中,加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成,该沉淀的化学式为BaSO4.
分析 (1)氨气的密度比空气小,采取向上排空气法收集;实验室用氯化铵与氢氧化钙在加热条件下制备氨气;
(2)丙中Cu与稀硝酸反应生成硝酸铜、NO与水,乙中大理石与盐酸反应生成CO2,排出装置中的空气,防止丙中NO与氧气反应;
(3)①由元素守恒可知,生成酸式盐为和KHSO4,反应的方程式为:2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O,氧化产物为CO2,还原产物为ClO2;
②该实验需要保持在60~80℃之间,所以缺少的一种必需的玻璃仪器名称是温度计;
③将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成,说明二氧化氯和硫化氢发生氧化还原生成SO42-.
解答 解:(1)氨气的密度比空气小,采取向上排空气法收集,所以应从短管进气,制备氨气的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:短;2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)大理石与盐酸反应生成CO2,能够排出装置中的空气,防止丙中NO与氧气反应,所以装置乙的作用是:利用碳酸钙与盐酸产生的CO2排尽装置中的空气,丙中产生NO的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,
故答案为:利用碳酸钙与盐酸产生的CO2排尽装置中的空气;3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;
(3)①由元素守恒可知,生成酸式盐为和KHSO4,反应的方程式为:2KClO3+H2C2O4+2H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+2CO2↑+2KHSO4+2H2O,氧化产物为CO2,还原产物为ClO2,该反应中氧化产物与还原产物的物质的量之比为1:1,
故答案为:1:1;
②该实验需要保持在60~80℃之间,所以缺少的一种必需的玻璃仪器名称是温度计,
故答案为:温度计;
③将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成,说明二氧化氯和硫化氢发生氧化还原生成SO42-,白色沉淀的化学式为BaSO4,
故答案为:BaSO4.
点评 本题考查实验室制氨气、实验基本操作、离子方程式、氧化还原反应等知识,注意对基础知识的理解掌握.

| A | B | |
| C | D |
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2.
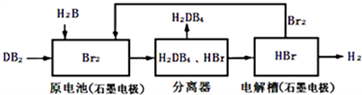
①查得:
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
②根据资料:
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
③在原电池中,负极发生的反应式为SO2+2H2O-2e-=4H++SO42-.
④在电解过程中,电解槽阴极附近溶液pH变大(填“变大”、“变小”或“不变”).
⑤将该工艺流程用总反应的化学方程式表示为:SO2+2H2O=H2+H2SO4.该生产工艺的优点有Br2被循环利用或能源循环供给或获得清洁能源(答一点即可).
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入Cl2,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为3 Br2+6 CO32-+3H2O=5 Br-+BrO3-+6HCO3-(或3 Br2+3CO32-=5 Br-+BrO3-+3CO2↑).
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是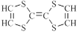 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为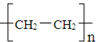 |
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
| A. | 为延长食品保质期,可向其中大量添加苯甲酸钠等防腐剂 | |
| B. | 催化转化机动车尾气为无害气体,能消除酸雨和雾霾的发生 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | “地沟油”可以制成肥皂,从而提高资源的利用率 |
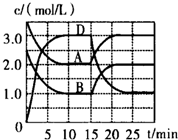 温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )
温度为T时,向V L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g)?C(s)+xD(g)△H>0,容器中A、B、D的物质的量浓度随时间的变化如图所示,下列说法不正确的是( )| A. | 反应在前10min的平均反应速率v(B)=0.15mol/(L•min) | |
| B. | 该反应的平衡常数表达式K=$\frac{{c}^{2}(D)}{c(A)•c(B)}$ | |
| C. | 若平衡时保持温度不变,压缩容器体积平衡向逆反应方向移动 | |
| D. | 反应至1.5min时,改变的反应条件是降低温度 |