题目内容
14.草酸(H2C2O4)是一种重要的化工原料,常温下其K1=5.4×10-2、K2=5.4×10-5.常温下几种草酸盐溶液的pH见下表:| 编号 | ① | ② | ③ |
| 溶液 | 0.01mol/L KHC2O4 | 0.01mol/L K2C2O4 | 溶液①与溶液②等体积混合 |
| pH | 3.1 | 8.1 | 未测定 |
| A. | ①中:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| B. | ②中:c(K+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) | |
| C. | ③中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) | |
| D. | ③中:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+) |
分析 A.HC2O4-与水都会电离出氢离子;
B.C2O42-水解生成HC2O4-与OH-,水电离出氢氧根离子;
C.HC2O4-与C2O42-的混合溶液中HC2O4-的电离程度大于C2O42-水解程度;
D.根据物料守恒和电荷守恒.
解答 解:A.HC2O4-与水都会电离出氢离子,所以溶液中c(H+)>c(C2O42-),则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故A错误;
B.C2O42-水解生成HC2O4-与OH-,水电离出氢氧根离子,则c(OH-)>c(HC2O4-),所以溶液中离子浓度大小的关系为:c(K+)>c(C2O42-)>c(OH-)>c(HC2O4-)>c(H+),故B错误;
C.HC2O4-与C2O42-的混合溶液中HC2O4-的电离程度大于C2O42-水解程度,溶液显酸性,则溶液中离子浓度大小的关系为:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-),故C错误;
D.0.01mol/L KHC2O4与0.01mol/L K2C2O4等体积混合,溶液中的物料守恒为:2c(K+)=3c(C2O42-)+3c(H2C2O4)+3c(HC2O4-),溶液中的电荷守恒为:c(K+)+c(H+)=2c(C2O42-)+c(HC2O4-)+c(OH-),联立两个关系式消去钾离子的浓度可得:2c(OH-)+c(C2O42-)=3c(H2C2O4)+c(HC2O4-)+2c(H+),故D正确.
故选D.
点评 本题考查离子浓度大小比较,题目涉及弱电解质的电离和盐的水解、物料守恒即电荷守恒的应用,题目难度中等,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列各组离子在指定条件下一定不能大量共存的是( )
| A. | 加入较多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2气体的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2气体的溶液中:Na+、SO32-、NH4+、SO42- |
2.下列说法正确的是( )
| A. | 已知:H2(g)+$\frac{1}{2}$O2(g)═H2O(l);△H=-285.8 kJ•mol-1,则H2的燃烧热为-285.8 kJ•mol-1 | |
| B. | 已知:S(g)+O2(g)═SO2(g)△H1=-Q1;S(s)+O2(g)═SO2(g)△H2=-Q2,则Q1<Q2 | |
| C. | 已知:$\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H1; CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)△H2,则有|△H1|<|△H2| | |
| D. | 已知:Fe2O3(s)+3C(石墨)═2Fe(s)+3CO(g)△H=+489.0 kJ•mol-1 CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H=-283.0 kJ•mol-1 C(石墨)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1 则4Fe(s)+3O2(g)═2Fe2O3(s)△H=-1641.0 kJ•mol-1 |
19.某校化学实验兴趣小组在“探究卤索单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入l~2滴溴水,振荡后溶液呈黄色.
提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
(3)结论:氧化性:Br2>Fe3+.故在足量的稀氯化亚铁溶液中,加入l~2滴溴水,溶液呈黄色所发生的离子反应方程式为Br2+2Fe2+=2Fe3++2Br-.
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol•L-1.
提出问题:Fe3+、Br2谁的氧化性更强?
(1)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(2)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.
供选用的试剂:a.酚酞试液;b.CCl4;c.无水酒精;d.KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是:Fe2+(填离子的化学式).
②在100mL FeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br-被氧气成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为1mol•L-1.
6.下列各组离子在溶液中可以大量共存的是( )
| A. | H+、SO32-、S2-、K+ | B. | Fe3+、Cl-、S2-、Ba2+ | ||
| C. | Cu2+、Cl-、S2-、K+ | D. | Na+、K+、S2-、SO42- |
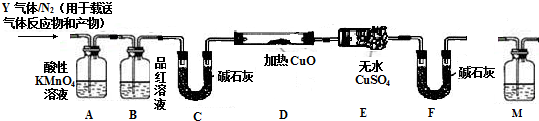
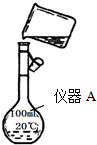 某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]
某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.实验操作过程如下:[废铁屑]$\stackrel{盐酸}{→}$[A溶液]$\stackrel{氯气}{→}$[氯气铁溶液]