题目内容
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
回答下列问题:
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示.在0~60s时段,反应速率v(N2O4)为 mol?L-1?s-1反应的平衡常数K1为 .
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动.

回答下列问题:
(1)反应的△H
(2)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向
考点:物质的量或浓度随时间的变化曲线,反应速率的定量表示方法,用化学平衡常数进行计算
专题:
分析:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,据此判断;反应速率利用公式v=
计算得到;化学平衡常数利用化学平衡常数表达式计算;
(2)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
| △c |
| △t |
(2)反应容器的容积减少一半,压强增大,根据反应前后气体体积大小判断化学平衡移动方向.
解答:
解:(1)随温度的升高,混合气体的颜色变深,化学平衡向正反应方向移动,即△H>0;0~60s时段,N2O4浓度变化为:0.1mol/L-0.04mol/L=0.06mol/L,v(N2O4)=
=0.0010mol?L-1?s-1;K=
=
=0.36mol/L,
故答案为:大于;0.0010;0.36mol/L;
(2)反应容器的容积减少一半,压强增大,平衡向着气体体积减小的方向移动,反应N2O4(g)?2NO2(g)正反应方向气体体积增大,故答案为:逆反应.
| 0.06mol/L |
| 60S |
| c2(NO) |
| c(N2O4) |
| (0.12mol/L)2 |
| 0.04mol/L |
故答案为:大于;0.0010;0.36mol/L;
(2)反应容器的容积减少一半,压强增大,平衡向着气体体积减小的方向移动,反应N2O4(g)?2NO2(g)正反应方向气体体积增大,故答案为:逆反应.
点评:本题考查化学平衡图象、影响平衡的因素、平衡常数影响因素、化学反应速率的计算等,难度不大.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
为确定某溶液的离子组成,进行如下实验:根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
| A、一定存在SO32-离子 |
| B、一定存在CO32-离子 |
| C、一定存在Cl-离子 |
| D、可能存在HCO3-离子 |
加入正催化剂使反应速率加快,下列叙述不正确的是( )
| A、使反应体系的活化能降低 |
| B、使反应体系的活化分子总数增多 |
| C、使反应体系的活化分子百分数降低 |
| D、使反应体系的活化分子百分数增大 |
四种短周期元素的性质或结构信息如下表.下列推断错误的是( )
| 元素编号 | 元素性质或结构 |
| T | M层上有2对成对电子 |
| X | 元素最高正价是+7价 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 单质是银白色固体、导电、密度比水小,与水剧烈反应、和氧气反应不同条件下产物不同 |
| A、T的氢化物是同族元素氢化物中沸点最低的 |
| B、X的最高价氧化物对应的水化物,是无机含氧酸中的最强酸 |
| C、离子半径从小到大的顺序:Y<Z<T<X |
| D、X、Y形成化合物的晶体类型与X、Z形成化合物的晶体类型不同 |
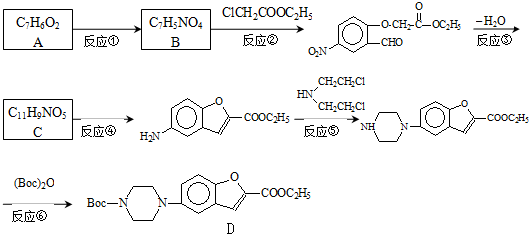
 ;
;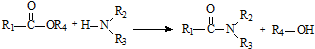 .
. 和
和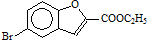 直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式
直接反应生成D,但实验中条件控制不当会发生副反应生成副产物,写出副产物有机物的结构简式
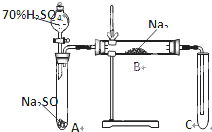 类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
类比思想是化学学习常用的方法.已知Na2O2能与CO2反应,甲同学受到启发,提出一个相似的观点:Na2O2与SO2也能够反应.该同学用下图所示的装置进行实验,充分反应,B中固体由淡黄色变为白色(Na2O2完全反应),将带火星的木条插入试管C中,木条复燃.
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题: