题目内容
 某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:
某兴趣小组的同学用如图所示装置研究有关电化学的问题.当闭合该装置的电键时,观察到电流计的指针发生了偏转.请回答下列问题:(1)甲装置的名称是
(2)写出电极反应式:Cu极
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色
(4)若乙中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)根据构成原电池的条件知:甲装置为铜锌原电池,Zn为负极,Cu为正极;乙装置为电解池,与正极相连的为阳极;
(2)Cu极上氢离子得电子;C极上铜离子得电子;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,转移0.2mol电子,根据电子守恒计算乙中产生的固体和气体;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,根据电镀原理分析;
(5)甲中反应消耗氢离子,乙中电解NaCl溶液生成氢氧化钠;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液,根据质量分数公式计算即可.
(2)Cu极上氢离子得电子;C极上铜离子得电子;
(3)根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,转移0.2mol电子,根据电子守恒计算乙中产生的固体和气体;
(4)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,根据电镀原理分析;
(5)甲中反应消耗氢离子,乙中电解NaCl溶液生成氢氧化钠;
(6)电解饱和硫酸钠溶液时,阳极上氢氧根离子放电,阴极上氢离子放电,实际上是电解的水,电解水后,溶液中硫酸钠过饱和导致析出晶体,剩余的电解质溶液仍是饱和溶液,析出的硫酸钠和水组成的也是饱和溶液,根据质量分数公式计算即可.
解答:
解:(1)由图中的铜、锌两种电极和电解质稀硫酸和闭合电路知:该装置为原电池,Zn活泼,则Zn作负极,Cu作正极,则乙装置为电解池,C极与负极相连为阴极,Pt极与正极相连为阳极;
故答案为:原电池;电解池;负;阳;
(2)甲装置为原电池,Cu极为正极,正极上氢离子得电子,正极上的反应为:2H++2e-=H2↑,乙装置为电解池,C极与负极相连为阴极,阴极上铜离子得电子,则电极反应为Cu2++2e-=Cu;
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(3)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,则溶液中铜离子的浓度不变,所以溶液的颜色不变;
故答案为:无变化;
(4)甲中发生的反应为Zn与氢离子的反应,反应消耗氢离子,则pH增大,乙中电极不变,将其溶液换成NaCl溶液,则乙中电解NaCl溶液生成氢氧化钠,所以溶液的pH增大;
故答案为:增大;增大.
故答案为:原电池;电解池;负;阳;
(2)甲装置为原电池,Cu极为正极,正极上氢离子得电子,正极上的反应为:2H++2e-=H2↑,乙装置为电解池,C极与负极相连为阴极,阴极上铜离子得电子,则电极反应为Cu2++2e-=Cu;
故答案为:2H++2e-=H2↑;Cu2++2e-=Cu;
(3)若乙中溶液不变,将其电极都换成铜电极,则为电镀池,阳极铜失电子生成铜离子,阴极铜离子得电子生成铜单质,则溶液中铜离子的浓度不变,所以溶液的颜色不变;
故答案为:无变化;
(4)甲中发生的反应为Zn与氢离子的反应,反应消耗氢离子,则pH增大,乙中电极不变,将其溶液换成NaCl溶液,则乙中电解NaCl溶液生成氢氧化钠,所以溶液的pH增大;
故答案为:增大;增大.
点评:本题考查了原电池和电解池原理,正确判断原电池和电解池是解本题关键,根据离子的放电顺序、串联电路中转移电子相等来分析解答,难度中等.

练习册系列答案
相关题目
有4种碳架如下的烃( )


| A、a和c是同分异构体 |
| B、a和d是同分异构体 |
| C、a和d都能发生加成反应 |
| D、只有b和c能发生加成反应 |
能正确表示下列反应的离子方程式是( )
| A、乙酸乙酯与氢氧化钠溶液反应:CH3COOC2H5+OH-→CH3COOH+C2H5O- | ||
B、用银氨溶液检验乙醛的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| C、向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
| D、甘氨酸与氢氧化钠溶液反应:H2N-CH2COOH+OH-→H2N-CHCOO-+H2O |
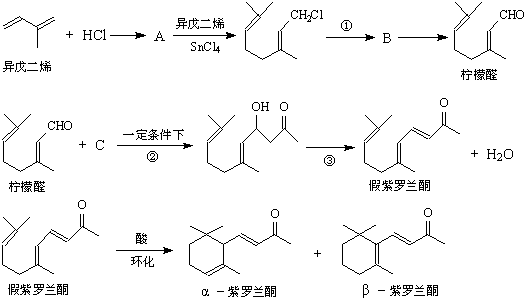

 如图所示,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
如图所示,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应. 如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是
如图所示的装置,C、D、E、F、X、Y都是惰性电极.将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色.则以下说法正确的是