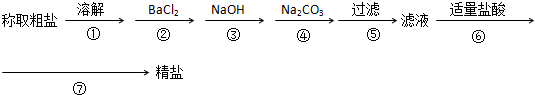
题目内容
下列有关事实的叙述正确的是( )
| A、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| B、玻璃钢、航天飞机上的隔热陶瓷瓦都属于复合材料 |
| C、氧化钠可作为呼吸面具和潜水艇里氧气的来源 |
| D、铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
考点:电解原理,原电池和电解池的工作原理,钠的重要化合物
专题:
分析:A、电解精炼铜,阳极上的锌和铁也会失电子生成离子,阳极泥是银、金等;
B、复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
C、依据氧化钠和二氧化碳反应不生成氧气分析;
D、铝空气燃料电池以NaOH溶液为电解液中负极反应为Al+4OH---3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH--+3O2═4AlO2-+2H2O.
B、复合材料是由两种或两种以上不同性质的材料,通过物理或化学的方法,在宏观上组成具有新性能的材料;
C、依据氧化钠和二氧化碳反应不生成氧气分析;
D、铝空气燃料电池以NaOH溶液为电解液中负极反应为Al+4OH---3e-═AlO2-+2H2O,正极反应为O2+2H2O+4e-=4OH-,总反应为4Al+4OH--+3O2═4AlO2-+2H2O.
解答:
解:A、电解精炼铜,阳极上的锌和铁也会失电子生成离子,阳极泥是银、金等,故A错误;
B、具有隔热性能的陶瓷瓦属于复合材料,故B正确;
C、氧化钠和二氧化碳反应生成碳酸钠,Na2O+CO2=Na2CO3,氧化钠不可用于呼吸面具作为氧气的来源,故C错误;
D、该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故D错误.
故选B.
B、具有隔热性能的陶瓷瓦属于复合材料,故B正确;
C、氧化钠和二氧化碳反应生成碳酸钠,Na2O+CO2=Na2CO3,氧化钠不可用于呼吸面具作为氧气的来源,故C错误;
D、该电池在碱性条件下消耗了碱,反应式为4Al+3O2+4OH-=4AlO2-+2H2O,溶液pH降低,故D错误.
故选B.
点评:本题考查了电解、原电池等基础知识,根据复合材料的概念、电解精炼铜原理、原电池原理等知识来分析解答即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法正确的是( )
| A、酯化反应、硝化反应以及酯的水解均属于取代反应类型 |
| B、乙醇生成溴乙烷和乙烯生成溴乙烷的反应类型相同 |
| C、可用氢氧化钠溶液除去乙酸乙酯中混有乙酸和乙醇 |
| D、蛋白质、淀粉、油脂均属于天然高分子化合物,均能发生水解反应 |
《实验化学》教材在教材结构、实验课题编排和内容选择等方面都作了精心设计.下列结论均出自《实验化学》中的实验,其中错误的是( )
| A、食醋用氢氧化钠溶液滴定开始时,溶液的pH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃 |
| B、当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据 |
| C、油墨是由多种色素按一定比例混合而成的,某同学欲用纸层析的方法将其主要色素分离开来,可选用的展开剂的物质是丙酮和盐酸 |
| D、提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量 |
用NA表示阿伏德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4LH2O含有的分子数为 NA |
| B、常温常压下,1.06g Na2CO3含有Na+离子个数为0.02 NA |
| C、含有阿伏德罗常数个微粒的物质就是1摩尔 |
| D、物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA |
氧化还原反应与四种基本类型反应的关系如图所示,则下列属于3区域的是( )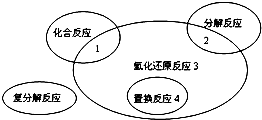

| A、Fe+CuSO4=FeSO4+Cu | ||||
B、2KMnO4
| ||||
| C、4Fe(OH)2+O2+2H2O=4Fe(OH)3 | ||||
| D、2Na2O2+2CO2=2Na2CO3+O2 |
下列各物质的晶体中,晶体类型相同的是( )
| A、CCl4与H2O |
| B、SiO2和CO2 |
| C、NaCl与金刚石 |
| D、MgCl2与Na |