题目内容
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
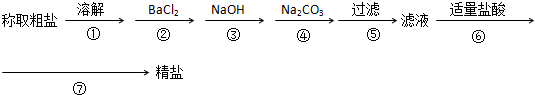
(1)判断BaCl2已过量的方法是
(2)第④步发生反应的离子方程式为
(3)第⑦步的操作需要的玻璃仪器有
(4)用氢氧化钠溶液吸收足量第⑥步生成的气体后,总反应的离子方程式为 .

(1)判断BaCl2已过量的方法是
(2)第④步发生反应的离子方程式为
(3)第⑦步的操作需要的玻璃仪器有
(4)用氢氧化钠溶液吸收足量第⑥步生成的气体后,总反应的离子方程式为
考点:粗盐提纯
专题:
分析:(1)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(2)碳酸钠可以除去两种杂质;
(3)依据蒸发结晶需要仪器回答;
(4)依据二氧化碳属于酸性气体,能与碱性溶液反应生成盐.
(2)碳酸钠可以除去两种杂质;
(3)依据蒸发结晶需要仪器回答;
(4)依据二氧化碳属于酸性气体,能与碱性溶液反应生成盐.
解答:
解:(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量;
(2)加入碳酸钠的目的是除去溶液中氯化钙以及先前加入的氯化钡,故离子反应方程式为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,故答案为:Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓;
(3)蒸发需要加热装置,故需要酒精灯,加热过程中需要搅拌,故需要玻璃棒,故答案为:酒精灯,玻璃棒;
(4)过量的二氧化碳与氢氧化钠反应生成碳酸氢钠,离子反应方程式为:OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
故答案为:取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量;
(2)加入碳酸钠的目的是除去溶液中氯化钙以及先前加入的氯化钡,故离子反应方程式为:Ba2++CO32-=BaCO3↓、Ca2++CO32-=CaCO3↓,故答案为:Ba2++CO32-=BaCO3↓ Ca2++CO32-=CaCO3↓;
(3)蒸发需要加热装置,故需要酒精灯,加热过程中需要搅拌,故需要玻璃棒,故答案为:酒精灯,玻璃棒;
(4)过量的二氧化碳与氢氧化钠反应生成碳酸氢钠,离子反应方程式为:OH-+CO2=HCO3-,故答案为:OH-+CO2=HCO3-.
点评:本题是一道物质的分离和提纯的方法和基本操作的综合应用题,要求学生具有分析和解决问题的能力,难度较大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
下列有关事实的叙述正确的是( )
| A、电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| B、玻璃钢、航天飞机上的隔热陶瓷瓦都属于复合材料 |
| C、氧化钠可作为呼吸面具和潜水艇里氧气的来源 |
| D、铝-空气燃料电池通常以NaOH溶液为电解液,电池在工作过程中电解液的pH保持不变 |
下列物质之间的转化符合“甲
乙
丙
丁”的组合是( )
①Na→NaOH;②Cu→Cu(OH)2;③S→H2SO4;④CH3CH2OH→CH3COOCH2CH3.
| O2 |
| O2 |
| H2O |
①Na→NaOH;②Cu→Cu(OH)2;③S→H2SO4;④CH3CH2OH→CH3COOCH2CH3.
| A、①③ | B、③④ |
| C、①②④ | D、①③④ |
下列生产过程中的变化不涉及氧化还原反应的是( )
| A、氮肥厂用氢气和氮气合成氨 |
| B、纯碱厂用侯氏制碱法制纯碱 |
| C、硫酸厂用接触法生产硫酸 |
| D、氯碱厂用电解饱和食盐水制烧碱 |
某短周期非金属元素R的原子核外最外层电子数是次外层电子数的一半,有关该元素的下列说法正确的是( )
| A、在自然界中只以化合态的形式存在 |
| B、RO32-所含电子数比NO3-的电子数多7 |
| C、最高氧化物能与水反应生成含氧酸 |
| D、气态氢化物比CH4稳定 |
 随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
随着能源与环境问题越来越被人们关注,碳一化学(C1化学)成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.