题目内容
14. 目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.
目前工业上制备丙烯腈(CH2=CHC≡N)有乙炔法、丙烯氨氧化法等.乙炔法:H-C≡C-H+HCN$→_{80-90℃}^{CuCl_{2}-NH_{4}Cl-HCl}$CH2=CHCN
丙烯氨氧化法:CH2=CHCH3+NH3+$\frac{3}{2}$O2$\stackrel{催化剂}{→}$CH2=CHCN+3H2O
(1)Cu2+基态核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.
(2)下列说法正确的是abcd(不定项选择).
a.NH4+空间构型呈正四面体
b.CH2=CHCN分子中所有原子位于同一平面
c.C2H2、HCN分子中所有原子均位于同一直线
d.NH3极易溶于H2O,除因为它们都是极性分子外,还因为NH3能与H2O分子间形成氢键
(3)与NH3互为等电子体的阳离子为H3O+(写化学式).
(4)丙烯腈分子中碳原子杂化轨道类型为sp、sp2;1mol丙烯腈分子中含有σ键的数目为6mol.
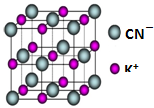
(5)HCN的钾盐晶胞结构可如右图所示,则该晶胞中与每个K+紧邻的K+数目为12(填数字).
分析 (1)Cu的原子序数为29,价电子排布为3d104s1,据此书写Cu2+的核外电子排布式;
(2)a.根据NH4+杂化轨道数=δ键数+孤对电子对数判断;
b.根据CH2=CHCN分子相当于一个碳碳双键和一个碳氮参键通过一个碳碳单键相连分析;
c.根据C2H2、HCN分子都为sp杂化判断;
d.根据相似相溶原理及其形成氢键分析溶解性;
(3)NH3含有4个原子,价电子总数为8个电子,结合等电子体的定义分析;
(4)丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;根据每个单键、双键、叁键都含有1个δ键,据此计算;
(5)以体心K+离子研究,与之距离相等且最近的K+位于棱的中点上,相等且最近的K+共有12个.
解答 解:(1)Cu的原子序数为29,价电子排布为3d104s1,则基态Cu2+的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9,
故答案为:1s22s22p63s23p63d9或[Ar]3d9;
(2)a.NH4+中氮原子杂化轨道数=δ键数+孤对电子对数=4+0=4,所以采取sp3杂化,所以空间构型呈正四面体,故正确;
b.CH2=CH-C≡N分子相当于一个碳碳双键和一个碳氮参键通过一个碳碳单键相连,所以所有原子都处在同一平面上,故正确;
c.C2H2、HCN分子都含有一个参键,所以都为sp杂化,则所有原子均位于同一直线,故正确;
d.因为NH3能与H2O分子间形成氢键,又NH3和H2O都是极性分子,所以根据相似相溶原理,则NH3极易溶于H2O,故正确;
故答案为:abcd;
(3)NH3含有4个原子,价电子总数为8个电子,则对应的等电子体有H3O+,故答案为:H3O+;
(4)通过丙烯氰的结构可以知道碳原子的杂化轨道类型为sp和sp2杂化;故答案为:sp杂化、sp2杂化;因为每个单键、双键、叁键都含有1个δ键,所以1mol丙烯腈分子中含有σ键的数目为6mol,故答案为:sp、sp2;6mol;
(5)以体心K+离子研究,与之距离相等且最近的K+位于棱的中点上,相等且最近的K+共有12个,故与与每个K+紧邻的K+数目为12个,故答案为:12.
点评 本题主要考查了电子排布式、原子的杂化、分子的空间构型、原子共面、分子的极性以及晶胞等知识,注意对应知识的掌握,题目难度中等,注意把握分子杂化类型的判断方法.

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| CO | Cl2 | COCl2 | COCl2 | ||
| Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
| Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
| Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
| A. | 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol•L-1•min-1 | |
| B. | 该反应正反应为吸热反应 | |
| C. | 容器Ⅱ中起始时Cl2的物质的量为0.55 mol | |
| D. | 若起始时向容器Ⅰ加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO转化率大于80% |
| A. | O3与SO2的结构相似 | B. | 硫粉不溶于水,易溶于CS2中 | ||
| C. | Be(OH)2是两性氢氧化物 | D. | 在相同条件下,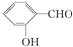 的沸点高于 的沸点高于 |

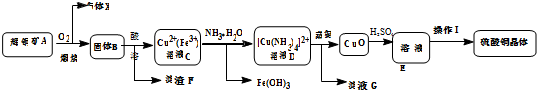
 $\stackrel{KMnO_{4}/H+}{→}$RCOOH+
$\stackrel{KMnO_{4}/H+}{→}$RCOOH+
 .B的结构简式是
.B的结构简式是 .
. .
. .
.
 .
.
 .
.

 .
.