题目内容
(1)在2L的密闭容器中,由CO2和H2合成甲醇:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),在其他条件不变的情况下,探究温度对反应的影响,
实验结果如图1所示(注:T2>T1,均大于300℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为 .
②通过分析图1,温度对反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的影响可以概括为 .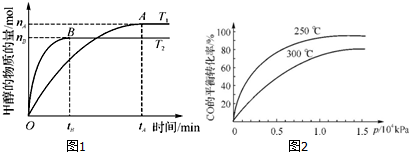
③下列情形能说明上述反应已达到平衡状态的是 (填字母).
A.体系压强保持不变
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存
C.CH3OH与H2物质的量之比为1:3
D.每消耗1mol CO2的同时生成3mol H2
④已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1和-726.5kJ?mol-1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式: .
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)?CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式K= ,250℃、0.5×104 kPa下的平衡常数 (填“>”、“<”或“=”)300℃、1.5×104 kPa下的平衡常数.
②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是 .
实验结果如图1所示(注:T2>T1,均大于300℃).
①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率为
②通过分析图1,温度对反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)的影响可以概括为

③下列情形能说明上述反应已达到平衡状态的是
A.体系压强保持不变
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存
C.CH3OH与H2物质的量之比为1:3
D.每消耗1mol CO2的同时生成3mol H2
④已知H2(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ?mol-1和-726.5kJ?mol-1,写出由CO2和H2生成液态甲醇和液态水的热化学方程式:
(2)在容积可变的密闭容器中,由CO和H2合成甲醇CO(g)+2H2(g)?CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图2所示.
①该反应的平衡常数表达式K=
②实际生产中,该反应条件控制在250℃、1.3×104 kPa左右,选择此压强而不选择更高压强的理由是
考点:化学平衡的影响因素,化学平衡状态的判断
专题:化学平衡专题
分析:(1)①根据反应速率v=
来计算即可;
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行;
③根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
④根据燃烧热的概念以及盖斯定律来计算化学反应的焓变;
(2)①根据K=
来书写K的表达式 温度对K的影响和反应的吸放热情况有关来回答;
②根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答.
| △c |
| △t |
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行;
③根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
④根据燃烧热的概念以及盖斯定律来计算化学反应的焓变;
(2)①根据K=
| 生成物浓度系数幂次方 |
| 反应物浓度系数幂次方 |
②根据压强对化学反应速率以及化学平衡移动的影响知识结合实际生产过程来回答.
解答:
解:(1)①温度为T2时,从反应开始到平衡,生成甲醇的平均反应速率v=
=
=
mol/(L?min),故答案为:
mol/(L?min);
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T2>T1,根据图一,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件一定时,对于该化学反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(l),升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动,
故答案为:当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动;
③A.该反应是一个反应前后气体系数和不同的反应,当体系压强保持不变,证明达到平衡,故A正确;
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存,只能证明是一个可逆反应,不能证明是平衡状态,故B错误;
C.CH3OH与H2物质的量之比为1:3,不能证明达平衡状态,故C错误;
D.每消耗1mol CO2的同时生成3molH2,能证明正逆反应速率相等,故D正确;
故答案为:AD;
④由H2(g)的燃烧热△H为-285.8kJ?mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
②CH3OH(l)+
O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ?mol-1,由盖斯定律可知,3×①-②得CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-130.9 kJ?mol-1,故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ?mol-1;
(2)①反应CO(g)+2H2(g)═CH3OH(g)的平衡常数K=
,根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道该反应是一个放热反应,所以升高温度,平衡常数减小,压强大小和平衡常数之间无关,即250℃、0.5×104kPa下的平衡常数大于300℃、1.5×104kPa下的平衡常数,
故答案为:
;>;
②根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
| △c |
| △t |
| ||
| tB |
| nB |
| 2tB |
| nB |
| 2tB |
②温度能加快化学反应速率,能使化学平衡向着吸热方向进行,T2>T1,根据图一,温度升高,甲醇的物质的量减小,所以平衡逆向移动,即所以当其他条件一定时,对于该化学反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(l),升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动,
故答案为:当其他条件一定时,升高温度,反应速率加快;当其他条件一定时,升高温度,平衡逆向移动;
③A.该反应是一个反应前后气体系数和不同的反应,当体系压强保持不变,证明达到平衡,故A正确;
B.密闭容器中CO2、H2、CH3OH(g)、H2O(g)4种气体共存,只能证明是一个可逆反应,不能证明是平衡状态,故B错误;
C.CH3OH与H2物质的量之比为1:3,不能证明达平衡状态,故C错误;
D.每消耗1mol CO2的同时生成3molH2,能证明正逆反应速率相等,故D正确;
故答案为:AD;
④由H2(g)的燃烧热△H为-285.8kJ?mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,即①H2(g)+
| 1 |
| 2 |
②CH3OH(l)+
| 1 |
| 2 |
(2)①反应CO(g)+2H2(g)═CH3OH(g)的平衡常数K=
| [CH3OH] |
| [CO]?[H2]2 |
故答案为:
| [CH3OH] |
| [CO]?[H2]2 |
②根据CO在不同温度下的平衡转化率与压强的关系图2,可以知道在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失,
故答案为:在1.3×104kPa下,CO的转化率已经很高,如果增加压强CO的转化率提高不大,而生产成本增加,得不偿失.
点评:本题目综合考查学生对化学平衡移动的影响、化学平衡状态的判断、以及化学平衡的计算知识,属于综合知识的考查,难度大.

练习册系列答案
相关题目
用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A、标准状况下,11.2 L水中含有的原子数是1.5NA |
| B、在常温常压下,1.7g NH3含有的原子数为0.4NA |
| C、0.2mol?L-1的 K2SO4溶液中含K+数目为0.4NA |
| D、1molCl2与足量Fe反应,转移的电子数为3NA |
C、Si、S都是重要的非金属元素,以下分析正确的是( )
| A、三者的单质均存在同素异形现象 |
| B、三者对应的氧化物均为酸性氧化物 |
| C、CO2、SiO2、SO2都能与H2O反应,其反应类型相同 |
| D、同温度、同浓度三溶液的pH:Na2SiO3<Na2SO3<Na2CO3 |
元素A的最高正价和负价的绝对值之差为6,则A元素可能形成的化合物是( )
| A、MgF2 |
| B、CaCl2 |
| C、K2S |
| D、Na2O |