题目内容
现有A、B、C、D四种短周期元素,原子序数依次递增;A是形成化合物种类最多的元素;B与D的质子数之和为27,最外层电子数之差为5;0.9克单质C与足量盐酸反应,收集到气体1.12L(标准状况).请回答下列问题:
(1)A元素的名称 ;画出C的原子结构示意图 ;D元素在元素周期表中的位置
(2)A的最高价氧化物与B的某种氧的化合物发生氧化还原反应,该反应化学方程式为 ;该反应中的氧化剂是 (用化学式表示);当有1mol B的该氧化物发生反应时,转移的电子数目是 个;
(3)A、B、C、D四种元素最高价氧化物对应的水化物中酸性最强的是 (用化学式表示),该酸的电离方程式为 ;
(4)B、C两种元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式为: .
(1)A元素的名称
(2)A的最高价氧化物与B的某种氧的化合物发生氧化还原反应,该反应化学方程式为
(3)A、B、C、D四种元素最高价氧化物对应的水化物中酸性最强的是
(4)B、C两种元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式为:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:令C的相对原子质量为Mr,化合价为x,根据电子转移得;
×x=
×2,即Mr=9x,C为短周期金属,x=1,Mr=9,不符合题意;x=2,Mr=18,不符合题意;x=3,Mr=27,符合题意,故B为Al元素;A是形成化合物种类最多的元素,则A为碳元素,B与D的质子数之和为27,最外层电子数之差为5,若B、D不在同周期,D的原子序数大于13,故D处于第三周期、B处于第二周期,没有元素同时满足质子数之和为27,最外层电子数之差为5,若B、D在同周期,则B+D=27,D-B=5,可得C=16,A=11,即B为钠、D为硫,据此解答.
| 0.9 |
| Mr |
| 1.12 |
| 22.4 |
解答:
解:令C的相对原子质量为Mr,化合价为x,根据电子转移得;
×x=
×2,即Mr=9x,C为短周期金属,x=1,Mr=9,不符合题意;x=2,Mr=18,不符合题意;x=3,Mr=27,符合题意,故B为Al元素;A是形成化合物种类最多的元素,则A为碳元素,B与D的质子数之和为27,最外层电子数之差为5,若B、D不在同周期,D的原子序数大于13,故D处于第三周期、B处于第二周期,没有元素同时满足质子数之和为27,最外层电子数之差为5,若B、D在同周期,则B+D=27,D-B=5,可得C=16,A=11,即B为钠、D为硫,
(1)由上面的分析可知,A为碳元素,C为铝元素,它的原子结构示意图为 ,D为硫元素,在元素周期表中第三周期VIA族,
,D为硫元素,在元素周期表中第三周期VIA族,
故答案为:碳; ;第三周期VIA族;
;第三周期VIA族;
(2)A的最高价氧化物为二氧化碳,与B的某种氧的化合物为过氧化钠发生氧化还原反应,反应化学方程式为 2Na2O2+2CO2═2Na2CO3+O2;该反应中的氧化剂是 Na2O2,还原剂也是Na2O2,所以当有1mol Na2O2发生反应时,转移的电子数目是 NA 个,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Na2O2;NA;
(3)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,在C、Na、Al、S中,S的非金属性最强,所以A、B、C、D四种元素最高价氧化物对应的水化物中酸性最强的是 H2SO4,该酸的电离方程式为 H2SO4═2H++SO42-,
故答案为:H2SO4;H2SO4═2H++SO42-;
(4)B、C两种元素的最高价氧化物对应的水化物分别为氢氧化钠和氢氧化铝,它们之间发生反应的离子方程式为:OH-+Al(OH)3═AlO2-+2H20,
故答案为:OH-+Al(OH)3═AlO2-+2H20;
| 0.9 |
| Mr |
| 1.12 |
| 22.4 |
(1)由上面的分析可知,A为碳元素,C为铝元素,它的原子结构示意图为
 ,D为硫元素,在元素周期表中第三周期VIA族,
,D为硫元素,在元素周期表中第三周期VIA族,故答案为:碳;
 ;第三周期VIA族;
;第三周期VIA族;(2)A的最高价氧化物为二氧化碳,与B的某种氧的化合物为过氧化钠发生氧化还原反应,反应化学方程式为 2Na2O2+2CO2═2Na2CO3+O2;该反应中的氧化剂是 Na2O2,还原剂也是Na2O2,所以当有1mol Na2O2发生反应时,转移的电子数目是 NA 个,
故答案为:2Na2O2+2CO2═2Na2CO3+O2;Na2O2;NA;
(3)元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,在C、Na、Al、S中,S的非金属性最强,所以A、B、C、D四种元素最高价氧化物对应的水化物中酸性最强的是 H2SO4,该酸的电离方程式为 H2SO4═2H++SO42-,
故答案为:H2SO4;H2SO4═2H++SO42-;
(4)B、C两种元素的最高价氧化物对应的水化物分别为氢氧化钠和氢氧化铝,它们之间发生反应的离子方程式为:OH-+Al(OH)3═AlO2-+2H20,
故答案为:OH-+Al(OH)3═AlO2-+2H20;
点评:本题主要考查了原子结构示意图、氧化还原反应、电离方程式、离子方程式等知识,中等难度,解题的关键在于元素的推断,解题的难点在于用讨论法推断元素的种类.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、标准状况下,22.4L氦气含有原子个数为NA |
| D、标准状况下,22.4 LH2O中含原子个数为3NA |
对水的电离平衡不产生影响的粒子是( )
A、 |
B、 |
| C、26R3+ |
D、 |
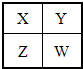 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径大 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、Y的气态氢化物的稳定性一定比W的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |