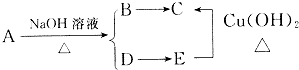题目内容
有机物X含有碳、氢、氧三种元素.
(1)探究X与钠反应产生气体的成分.
①X与钠反应产生的气体具有可燃性.将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊.则X与钠反应产生的气体为 .
②根据苯、乙烷等碳氢化合物不能与钠反应产生上述气体这一事实,可得出X分子里有不同于烃分子里的氢原子存在.即有机物X除含有碳氢键之外,还有的化学键是 键.
(2)工业上,X可由乙烯与水反应制得,则X的分子式是 .
X分子含有的官能团的名称是 .写出X发生催化氧化反应的化学方程式 .
(3)X能被酸性高锰酸钾或重铬酸钾氧化为生活中的另一种重要的有机化合物Y,X与Y发生反应的化学方程式是 .为了提高该反应的反应速率,可采取的措施是 .可用某溶液除去产品中混有的杂质,写出除杂过程发生反应的化学反应方程式 .
(1)探究X与钠反应产生气体的成分.
①X与钠反应产生的气体具有可燃性.将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊.则X与钠反应产生的气体为
②根据苯、乙烷等碳氢化合物不能与钠反应产生上述气体这一事实,可得出X分子里有不同于烃分子里的氢原子存在.即有机物X除含有碳氢键之外,还有的化学键是
(2)工业上,X可由乙烯与水反应制得,则X的分子式是
X分子含有的官能团的名称是
(3)X能被酸性高锰酸钾或重铬酸钾氧化为生活中的另一种重要的有机化合物Y,X与Y发生反应的化学方程式是
考点:有机物的推断
专题:有机物的化学性质及推断
分析:(1)①将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,说明气体含有氢元素,可能含有氧元素,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊,说明不含碳元素,排除一氧化碳、甲烷等可燃性气体,只能为氢气;
②能和金属钠反应生成氢气的有机物需含有羟基结构;
(2)乙烯分子含有碳碳双键,和水发生加成反应生成乙醇,乙醇含有官能团为羟基,乙醇催化氧化生成乙醛;
(3)乙醇能被酸性高锰酸钾或重铬酸钾氧化为乙酸,和乙醇在浓硫酸作用下加热生成乙酸乙酯和水;根据影响化学反应速率的因素分析解答,化学反应温度高,反应快,酯化反应是可逆的,从化学平衡角度分析,乙酸与乙醇反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,催化剂能加快反应速率;产品中混有的杂质为乙酸和乙醇,乙醇易溶于水,乙酸用碳酸钠溶液除,碳酸钠溶液和足量乙酸反应生成醋酸钠、二氧化碳和水;
②能和金属钠反应生成氢气的有机物需含有羟基结构;
(2)乙烯分子含有碳碳双键,和水发生加成反应生成乙醇,乙醇含有官能团为羟基,乙醇催化氧化生成乙醛;
(3)乙醇能被酸性高锰酸钾或重铬酸钾氧化为乙酸,和乙醇在浓硫酸作用下加热生成乙酸乙酯和水;根据影响化学反应速率的因素分析解答,化学反应温度高,反应快,酯化反应是可逆的,从化学平衡角度分析,乙酸与乙醇反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,催化剂能加快反应速率;产品中混有的杂质为乙酸和乙醇,乙醇易溶于水,乙酸用碳酸钠溶液除,碳酸钠溶液和足量乙酸反应生成醋酸钠、二氧化碳和水;
解答:
解:(1)①有机物X含有碳、氢、氧三种元素,探究X与钠反应产生气体的成分,将气体点燃,把一干燥的小烧杯罩在火焰上,片刻在烧杯壁上出现液滴,说明有水生成,该气体一定含有氢元素,可能含有碳元素、氧元素,迅速倒转烧杯,向烧杯中加入少量澄清石灰水,未见浑浊,说明不含碳元素,排除一氧化碳、甲烷等可燃性气体,只能为氢气;
故答案为:氢气;
②有机物X含有碳、氢、氧三种元素,X能与金属钠反应,苯、乙烷等碳氢化合物不能与钠反应,有机物醇、羧酸能和金属钠反应,它们都含有羟基结构,除含有碳氢键之外,还有的化学键是氧氢键(O-H),
故答案为:氧氢键(O-H);
(2)乙烯分子含有碳碳双键,和水发生加成反应CH2=CH2+H2O
CH3CH2OH,则X的分子式是C2H6O,乙醇含有官能团为羟基(-OH),乙醇和氧气在铜或银作催化剂作用下催化反应生成B,2CH3CH2OH+O2
2CH3CHO+2H2O,
故答案为:C2H6O;羟基;2CH3CH2OH+O2
2CH3CHO+2H2O;
(3)乙醇能被酸性高锰酸钾或重铬酸钾氧化为乙酸,乙酸和乙醇在浓硫酸作用下加热生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,
CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,
故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
故答案为:氢气;
②有机物X含有碳、氢、氧三种元素,X能与金属钠反应,苯、乙烷等碳氢化合物不能与钠反应,有机物醇、羧酸能和金属钠反应,它们都含有羟基结构,除含有碳氢键之外,还有的化学键是氧氢键(O-H),
故答案为:氧氢键(O-H);
(2)乙烯分子含有碳碳双键,和水发生加成反应CH2=CH2+H2O
| 催化剂 |
| Cu或Ag |
| △ |
故答案为:C2H6O;羟基;2CH3CH2OH+O2
| Cu或Ag |
| △ |
(3)乙醇能被酸性高锰酸钾或重铬酸钾氧化为乙酸,乙酸和乙醇在浓硫酸作用下加热生成乙酸乙酯和水,反应的化学方程式为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,
CH3COOCH2CH3+H2O;化学反应温度高,反应快,酯化反应是可逆过程,乙酸与乙醇反应,浓硫酸吸水有利于平衡向生成乙酸乙酯方向移动,催化剂浓硫酸,能加快反应速率,常用饱和碳酸钠溶液,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,碳酸钠溶液和足量乙酸反应的方程式为:Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑,故答案为:CH3COOH+CH3CH2OH
 CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
CH3COOCH2CH3+H2O;加热、使用催化剂浓硫酸;Na2CO3+2CH3COOH═2CH3COONa+H2O+CO2↑;
点评:本题考查有机物的推断,涉及烯、醇、醛、羧酸等的性质与转化等,根据X结合物质的性质利用顺推法进行判断,注意掌握常用化学用语的书写,注意对基础知识的理解掌握,题目难度中等.

练习册系列答案
相关题目
对水的电离平衡不产生影响的粒子是( )
A、 |
B、 |
| C、26R3+ |
D、 |
下列科研成果不是由我国发明或创造的是( )
| A、世界上第一个由人工合成的、具有生理活性的蛋白质--结晶牛胰岛素 |
| B、世界上首次人工合成的酵母丙氨酸转移核糖核酸 |
| C、发现元素周期律 |
| D、黑火药和造纸 |
1mol 某烃完全燃烧后,能生成二氧化碳112L(标准状况下),此烃在一定条件下能与氢气加成,最多能消耗两倍于其体积的氢气,则此烃的结构简式可能为( )
| A、CH3-CH=CH2 |
| B、CH3-CH=CH-CH=CH2 |
| C、CH3-CH=CH-CH2-CH3 |
| D、CH2=CH2 |