题目内容
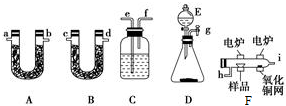
13. 图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.
图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:2H++2e-=H2↑.
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置能(填“能”或“不能”)形成原电池,若不能,请说明理由;若能,请指出正、负极材料:Al为负极,Mg为正极.当反应中收集到标准状况下224mL气体时,消耗的电极质量为0.18g.
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所产生的化学能直接转化为电能.
现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入b极(填a或b,下同),电子从b极流出,电解质溶液中OH-向b极移动.
(4)等质量的下列物质分别完全燃烧,放出热量较多的是B(填编号)
A.固体硫 B.硫蒸气.
分析 (1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,负极上Al失去电子;
(2)Al、Mg、NaOH溶液构成的原电池中,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,根据电池反应来解答;
(3)原电池中,电子从负极流出,阴离子移向负极;
(4)等质量的硫蒸气具有的能量比硫固体多.
解答 解:(1)Al、Cu、稀硫酸构成的原电池,金属Al作负极,金属Cu为正极,正极上氢离子得到电子,正极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)Al、Mg、NaOH溶液可构成原电池,Al为负极,Mg为正极,负极上Al失去电子,正极上水中的氢离子得到电子,发生电池离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,当反应中收集到标准状况下224mL即0.01mol气体时,耗的电极Al的质量为:$\frac{0.02mol}{3}$×27g/mol=0.18g,
故答案为:能;Al为负极,Mg为正极;0.18;
(3)甲烷燃料电池中,通入燃料甲烷的电极是负极,电子从负极流出,电解质里的阴离子移向负极,故答案为:b;b;b;
(4)等质量的硫蒸气和硫固体相比较,硫蒸气具有的能量多,因此完全燃烧硫蒸气放出的热量多,故答案为:B.
点评 本题考查原电池原理,为高频考点,把握图中装置的分析及原电池的工作原理为解答的关键,侧重电极、电极反应、转移电子的考查,注意(2)中不能直接利用金属活泼性判断负极,应从氧化还原反应的角度考虑,题目难度不大.

练习册系列答案
相关题目
3.下列有关元素周期律的叙述正确的是( )
| A. | 随着原子序数的递增,原子最外层电子数总是从1到8重复出现 | |
| B. | 元素的性质随着原子序数的递增而呈周期性变化 | |
| C. | 随着原子序数的递增,元素的最高正价从+1到+7,负价从-7到-1重复出现 | |
| D. | 元素周期律的实质是元素化合价呈周期性变化 |
18.下列元素中,最高正化合价数值最大的是( )
| A. | Cl | B. | F | C. | C | D. | Na |
5.下列有关物质分类或归纳的说法中,正确的是( )
| A. | 蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体 | |
| B. | 聚乙烯、聚氯乙烯,纤维素都属于合成高分子 | |
| C. | 分馏、干馏,裂化都是化学变化 | |
| D. | 石蜡油分解产物可使溴水和酸性高锰酸钾溶液褪色 |