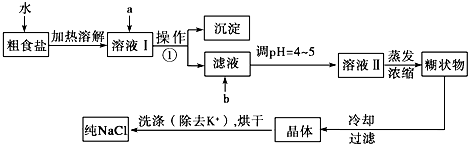
题目内容
9. 现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、NO32-、CO32-、X中的一种.(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是K2CO3和Ba(OH)2.
(2)物质C中含有离子X.为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体.则X为B(填字母).
A.Br- B.SO42- C.CH3COO- D.HCO3-
(3)将19.2g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,若要将Cu完全溶解,至少加入H2SO4的物质的量是0.4mol.
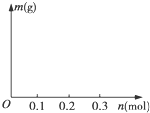
(4)若用惰性电极电解C和D的混合溶液,溶质的物质的量均为0.1mol,请在坐标系中画出通电后阴极析出固体的质量m与通过电子的物质的量n的关系.(标明纵坐标数值)
(5)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-═2Fe2++I2.
分析 CO32-与Fe3+、Cu2+、Ba2+、Al3+不能大量共存,OH-与Fe3+、Cu2+、Al3+不能大量共存;则必有的两种物质记为A、B,A、B分别为K2CO3、Ba(OH)2,C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则A应为Ba(OH)2,C中含SO42-,则C为CuSO4,D为Al(NO3)3,E为FeCl3,据此分析解答即可.
解答 解:CO32-与Cu2+、Ba2+、Fe3+、Al3+不能大量共存,OH-与Fe3+、Al3+、Cu2+不能大量共存,则必有的两种物质记为A、B,A、B分别为K2CO3、Ba(OH)2,C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体,蓝色沉淀为氢氧化铜,白色沉淀为硫酸钡,则A应为Ba(OH)2,C中含SO42-,则C为CuSO4,D为Al(NO3)3,E为FeCl3,
(1)由上述分析可知,必有的两种物质为K2CO3、Ba(OH)2,
故答案为:K2CO3;Ba(OH)2;
(2)由上述分析可知,C为CuSO4,C中X为SO42-,
故答案为:B;
(3)根据以上推断可知D中含有NO3-,已知将19.2gCu投入装有足量D溶液的试管中,Cu不溶解;再滴加稀H2SO4,Cu逐渐溶解,
发生的反应为3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
则n(Cu)=mM=$\frac{19.2g}{64g/mol}$=0.3mol,
有方程可知$\frac{3}{8}$=$\frac{0.3mol}{n({H}^{+})}$,
所以n(H+)=0.8mol,
所以n(H2SO4)=12n(H+)=0.4mol,
故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.4mol;
(4)阴极上阳离子放电:Cu2++2e-═Cu,转移0.2mol电子时Cu2+放电完全,得到金属Cu 6.4g,之后水电离出的H+放电:2H++2e-═H2↑,固体的质量不再变化,故答案为: ;
;
(5)E为FeCl3,E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2.
点评 本题综合性较强,涉及无机物推断、离子检验、离子方程式的书写等,需要学生熟练掌握基础知识,有利于考查学生的推理能力,难度中等.

 一线名师权威作业本系列答案
一线名师权威作业本系列答案 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 |
| C | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
| D | 验证醋酸、碳酸、硅酸酸性强弱 | NaOH溶液 | Na2SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  | B. |  | C. | 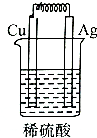 | D. | 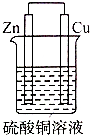 |
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
| A. | 气态单质分子中一定存在共价键 | |
| B. | 氯化钠熔化或氯化氢溶于水时都要破坏化学键 | |
| C. | 金属甲、乙各1mol均和足量的盐酸反应,甲比乙失电子多,说明甲的金属性比乙的金属性强 | |
| D. | 原电池把化学能直接转化为电能,所以由原电池提供的电能是一次能源 |