题目内容
 (1)已知:
(1)已知:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
H2O(l)═H2O(g)△H=+44kJ/mol
写出1mol氢气完全燃烧生成液态水的热化学方程式
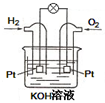
(2)以氢气为燃料组成的燃料电池如图所示,写出负极的电极反应式
(3)原电池工作时,电子从
考点:用盖斯定律进行有关反应热的计算,化学电源新型电池
专题:化学反应中的能量变化,电化学专题
分析:(1)依据热化学方程式和盖斯定律计算得到1mol氢气完全燃烧生成液态水的热化学方程式;
(2)根据原电池原理判断正负极上反应的物质,结合电解质溶液写出电极反应式;
(3)原电池中,易失电子的金属作负极,另一种金属作正极,电子从负极沿导线流向正极;从能量转化角度看,原电池是一种将化学能转化为电能的装置.
(2)根据原电池原理判断正负极上反应的物质,结合电解质溶液写出电极反应式;
(3)原电池中,易失电子的金属作负极,另一种金属作正极,电子从负极沿导线流向正极;从能量转化角度看,原电池是一种将化学能转化为电能的装置.
解答:
解:(1)①2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol
②H2O(l)═H2O(g)△H=+44kJ/mol
根据盖斯定律,①×
-②得:H2(g)+
O2(g)═H2O(g)△H=(-484kJ/mol)×
-44kJ/mol=-286kJ/mol;
故答案为:H2(g)+
O2(g)═H2O(g)△H=-286kJ/mol;
(2)氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应,电解质溶液是KOH溶液(碱性电解质)
负极发生的反应为:H2-2e-═2H+,2H++2OH-═2H2O,所以:负极的电极反应式为:
H2-2e-+2OH-═2H2O;故答案为:H2-2e-+2OH-═2H2O;
(3)原电池中,易失电子的金属作负极,另一极为正极,电子从负极沿导线流向正极,
从能量转化角度看,原电池是一种将化学能转化为电能的装置,故答案为:负、正、化学、电.
②H2O(l)═H2O(g)△H=+44kJ/mol
根据盖斯定律,①×
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(2)氢氧燃料电池工作时,氢气失电子是还原剂,发生氧化反应,电解质溶液是KOH溶液(碱性电解质)
负极发生的反应为:H2-2e-═2H+,2H++2OH-═2H2O,所以:负极的电极反应式为:
H2-2e-+2OH-═2H2O;故答案为:H2-2e-+2OH-═2H2O;
(3)原电池中,易失电子的金属作负极,另一极为正极,电子从负极沿导线流向正极,
从能量转化角度看,原电池是一种将化学能转化为电能的装置,故答案为:负、正、化学、电.
点评:本题考查了用盖斯定律计算反应热和原电池原理,较简单,注意原理的应用.

练习册系列答案
相关题目
在1200℃时,天然气脱硫工艺中会发生下列反应 H2S(g)+
O2(g)=SO2(g)+H2O(g)△H1 2H2S(g)+SO2(g)=
S2(g)+2H2O(g)△H2 H2S(g)+
O2(g)=S(g)+H2O(g)△H3 2S(g)=S2(g)△H4则△H4的正确表达式为( )
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
A、△H4=
| ||
B、△H4=
| ||
C、△H4=
| ||
D、△H4=
|
已知下列热化学方程式:Zn(s)+
O2(g)=ZnO(s)△H=-351.1kJ?mol-1 Hg(l)+
O2(g)=HgO(s)△H=-90.7kJ?mol-1由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、-260.4 kJ?mol-1 |
| B、-441.8 kJ?mol-1 |
| C、260.4 kJ?mol-1 |
| D、441.8 kJ?mol-1 |
下列各组物质,不能按 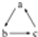 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )
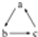 (“-→”表示反应一步完成)关系转化的是( )
(“-→”表示反应一步完成)关系转化的是( )| 选项 | a | b | c |
| A | Al2O3 | NaAlO2 | Al(OH)3 |
| B | AlCl3 | Al(OH)3 | NaAlO2 |
| C | Al | Al(OH)3 | Al2O3 |
| D | MgCl2 | Mg(OH)2 | MgO |
| A、A | B、B | C、C | D、D |
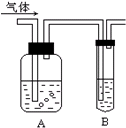 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )