题目内容
已知:①2C(s)+O2(g)═2CO(g)△H=-221.0kJ?mol-1;
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
②2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1.
则制备水煤气的反应C(s)+H2O(g)═CO(g)+H2(g)的△H为( )
| A、262.6 kJ?mol-1 |
| B、-131.3 kJ?mol-1 |
| C、-352.3 kJ?mol-1 |
| D、131.3 kJ?mol-1 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:利用盖斯定律,
①-
②得到 C(s)+H2O(g)═CO(g)+H2(g)△H,反应热随之相加减,可求得反应热.
| 1 |
| 2 |
| 1 |
| 2 |
解答:
解:①2C(s)+O2(g)═2CO(g);△H=-221.0KJ/mol
②2H2(g)+O2(g)═2H2O;△H=-483.6KJ/mol
依据盖斯定律
①-
②得到 C(s)+H2O(g)═CO(g)+H2(g)
△H=
(-221.0+483.6)kJ/mol=+131.3kJ/mol,
故选D.
②2H2(g)+O2(g)═2H2O;△H=-483.6KJ/mol
依据盖斯定律
| 1 |
| 2 |
| 1 |
| 2 |
△H=
| 1 |
| 2 |
故选D.
点评:本题考查反应热的计算,为化学反应原理部分考试热点,题目难度不大,注意盖斯定律的运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |

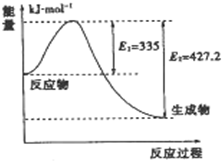 到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.

 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: