题目内容
已知25℃时一些难溶物质的溶度积常数如下:
根据上表数据,判断下列化学方程式不正确的是( )
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
| A、2AgCl+Na2S═2NaCl+Ag2S | ||||
B、MgCO3+H2O
| ||||
| C、ZnS+2H2O═Zn(OH)2+H2S↑ | ||||
| D、Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:A、依据表中给出的数据判断AgCl的溶解度大于Ag2S的溶解度,故沉淀发生转化,写方程式判断即可;
B、依据表中的数据判断MgCO3的溶解度大于Mg(OH)2的溶解度,故沉淀发生转化,写方程式判断即可;
C、依据表中的数据判断Zn(OH)2的溶解度大于ZnS的溶解度,故沉淀发生转化,写方程式判断即可;
D、依据经验判断,写出化学反应方程式判断即可.
B、依据表中的数据判断MgCO3的溶解度大于Mg(OH)2的溶解度,故沉淀发生转化,写方程式判断即可;
C、依据表中的数据判断Zn(OH)2的溶解度大于ZnS的溶解度,故沉淀发生转化,写方程式判断即可;
D、依据经验判断,写出化学反应方程式判断即可.
解答:
解:A、由表格判断AgCl的溶解度大于Ag2S的溶解度,故可以发生反应:2AgCl+Na2S═2NaCl+Ag2S,即难溶物质有转化为更难溶物质的性质,故A正确;
B、由表中的数据判断MgCO3的溶解度大于Mg(OH)2的溶解度,故可以发生反应:MgCO3+H2O
Mg(OH)2+CO2↑,即MgCO3沉淀发生转化为更难溶的Mg(OH)2,故B正确;
C、由表中的数据判断Zn(OH)2的溶解度大于ZnS的溶解度,故可以发生反应Zn(OH)2+H2S=ZnS↓+2H2O,故C错误;
D、据经验可知:Mg(HCO3)2和2Ca(OH)2的溶解度均分别大于Mg(OH)2和2CaCO3的溶解度,故可以发生反应:Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O,故D正确.
故选C.
B、由表中的数据判断MgCO3的溶解度大于Mg(OH)2的溶解度,故可以发生反应:MgCO3+H2O
| ||
C、由表中的数据判断Zn(OH)2的溶解度大于ZnS的溶解度,故可以发生反应Zn(OH)2+H2S=ZnS↓+2H2O,故C错误;
D、据经验可知:Mg(HCO3)2和2Ca(OH)2的溶解度均分别大于Mg(OH)2和2CaCO3的溶解度,故可以发生反应:Mg(HCO3)2+2Ca(OH)2═Mg(OH)2↓+2CaCO3↓+2H2O,故D正确.
故选C.
点评:本题考查学生沉淀溶解平衡原理,沉淀转化的原理,会从题给的表格中筛选有用的信息是解题关键,题目难度不大.

练习册系列答案
相关题目
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
Cl2(g)+H2(g)=2HCl(g )△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
用CH4催化还原NOx可以消除氮氧化物的污染.例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1.若在标准状况下4.48L CH4恰好能将一定量NO2还原成N2和H2O(g),则整个过程中放出的热量为( )
| A、114.8 kJ |
| B、232 kJ |
| C、368.8 kJ |
| D、173.4 kJ |
下列关于钠的叙述中,不正确的是( )
| A、钠燃烧时发出黄色的火焰 |
| B、钠燃烧时生成氧化钠 |
| C、钠有很强的还原性 |
| D、钠原子的最外层只有一个电子 |
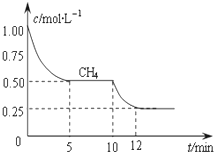 合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有:
合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料.从天然气获得合成气过程中可能发生的反应有: