题目内容
下列各溶液中,Na+浓度最大的是( )
| A、1L0.5mol/L的NaOH溶液 |
| B、2L0.4mol/L的NaNO3溶液 |
| C、3L0.3mol/L的NaCl溶液 |
| D、4L0.2mol/L的Na3PO4溶液 |
考点:物质的量浓度
专题:物质的量浓度和溶解度专题
分析:电解质离子的浓度=电解质浓度×电解质电离出该离子的数目,与溶液的体积无关,据此结合选项判断.
解答:
解:A、1L0.5mol/L的NaOH溶液中Na+浓度为0.5mol/L×1=0.5mol/L;
B、2L0.4mol/L的NaNO3溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
C、3L0.3mol/L的NaCl溶液中Na+浓度为0.3mol/L×1=0.3mol/L;
D、4L0.2mol/L的Na3PO4溶液中Na+浓度为0.2mol/L×3=0.6mol/L;
故选D.
B、2L0.4mol/L的NaNO3溶液中Na+浓度为0.4mol/L×1=0.4mol/L;
C、3L0.3mol/L的NaCl溶液中Na+浓度为0.3mol/L×1=0.3mol/L;
D、4L0.2mol/L的Na3PO4溶液中Na+浓度为0.2mol/L×3=0.6mol/L;
故选D.
点评:本题考查物质的量浓度,比较基础,注意电解质溶液中离子的浓度与电解质浓度的计算.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
下列化学反应的离子方程式书写正确的是( )
| A、往碳酸镁固体中滴加稀盐酸:CO32-+2H+═CO2↑+H2O |
| B、往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
| D、澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L?s),10s后容器内B的物质的量浓度为( )
| A、1.6 mol/L |
| B、1.4 mol/L |
| C、3.2 mol/L |
| D、1.8 mol/L |
下列各电离方程式中,书写正确的是( )
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?K++H++SO42- |
| C、Al(OH)3?Al3++3OH- |
| D、NaH2PO4?Na++H2PO42- |
如果a g某气体中含有该气体的分子数为b,则cg该气体在标准状况下的体积是(各选项中NA为阿伏加德罗常数的值)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
胶体和溶液的根本区别在于( )
| A、外观是否均一 |
| B、分散质粒子是否带电荷 |
| C、分散质粒子的大小 |
| D、分散系是否有颜色 |
下列按混合物、纯净物、电解质和非电解质顺序排列的是( )
| A、盐酸、空气、醋酸、干冰 |
| B、漂白粉、胆矾、氯化钾、硫酸钡 |
| C、蛋白质、油脂、苛性钾、碳酸钙 |
| D、福尔马林、冰醋酸、硫酸钠、乙醇 |
用于净化汽车尾气的反应:2NO(g)+2CO(g)?2CO2(g)+N2(g),已知该反应在570K时几乎完全反应,但反应速率极慢.下列说法正确的是( )
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
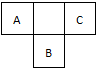 短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空:
短周期元素的A、B、C,在元素周期表中的位置如图所示,已知A元素单质是空气中含量最多的气体,A、C两种元素的原子核外电子数之和等于B元素的质子数,据此填空: