题目内容
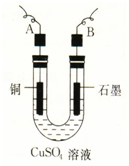 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:(1)该装置中B电极为电解池的
(2)A电极上的电极反应式为
电解池总反应的离子方程式为
(3)电解过程中,电解质溶液的酸性
(4)下列实验操作中必要的是
(A)称量电解前的电极的质量;
(B)电解后,电极在烘干称量前,必须用蒸馏水冲洗;
(C)刮下电解后电极上析出的铜,并清洗,称量;
(D)电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法.
(5)铜的相对原子质量为
考点:电解原理
专题:电化学专题
分析:(1)电解硫酸铜生成铜与氧气,故Cu电极连接电源的负极,石墨电极连接电源的正极;
(2)电解硫酸铜在阳极上生成氧气,在阴极上生成金属铜,电解产物是金属铜、氧气和硫酸;
(3)电解产生的电解质成分是硫酸,显酸性;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干.
(5)根据电子转移守恒计算Cu的相对原子质量.
(2)电解硫酸铜在阳极上生成氧气,在阴极上生成金属铜,电解产物是金属铜、氧气和硫酸;
(3)电解产生的电解质成分是硫酸,显酸性;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干.
(5)根据电子转移守恒计算Cu的相对原子质量.
解答:
解:(1)电解硫酸铜生成铜与氧气,故Cu电极连接电源的负极,A是阴极,石墨电极连接电源的正极,B是阳极,故答案为:阳;
(2)电解硫酸铜在阳极上生成氧气,在阴极上生成金属铜,Cu2++2e-=Cu,电解产物是金属铜、氧气和硫酸,实质是:2Cu2++2H2O
2Cu↓+O2↑+4H+,故答案为:Cu2++2e-=Cu;2Cu2++2H2O
2Cu↓+O2↑+4H+;
(3)电解过程中:2Cu2++2H2O
2Cu↓+O2↑+4H+,电解质溶液的酸性增强,故答案为:增强;
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干,故需要进行ABDE操作,不需要进行C操作,
故答案为:ABDE;
(5)VmL氧气的物质的量为
=
mol,令Cu的相对原子质量为Mr,根据电子转移守恒,则
×2=
mol×4,解得Mr=
,
故答案为:
.
(2)电解硫酸铜在阳极上生成氧气,在阴极上生成金属铜,Cu2++2e-=Cu,电解产物是金属铜、氧气和硫酸,实质是:2Cu2++2H2O
| ||
| ||
(3)电解过程中:2Cu2++2H2O
| ||
(4)需要准确称量生成铜的质量,铜电极前后质量之差为生成的Cu的质量,Cu电解表面会附着离子,应清洗除去,由于铜与氧气发生反应,在空气存在情况下,应低温烘干,称量两次之差小于天平的感量,说明烘干,故需要进行ABDE操作,不需要进行C操作,
故答案为:ABDE;
(5)VmL氧气的物质的量为
| V×10-3L |
| 22.4L/mol |
| V |
| 22400 |
| m |
| Mr |
| V |
| 22400 |
| 11200m |
| V |
故答案为:
| 11200m |
| V |
点评:本题以测定Cu的相对原子质量为载体,考查电解原理、对工艺流程的理解、常用化学用语、化学计算等,难度中等,理解工艺流程是解题的关键,需要学生具有扎实的基础与综合运用知识分析、解决问题的能力.

练习册系列答案
相关题目
4A(s)+3B(g)═2C(g)+D(g),经2min后B的浓度减少0.6mol?L-1.对此反应速率的表示正确的是( )
| A、用A表示的反应速率是0.4mol?L-1?min-1 |
| B、分别用B、C、D表示反应速率,其比值是3:2:1 |
| C、在2min末的反应速率,用B表示是0.3mol?L-1?min-1 |
| D、在2min内的反应速率,用C表示是0.3mol?L-1?min-1 |
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
当电解质溶液为H2SO4水溶液的氢氧燃料电池电解饱和Na2CO3溶液一段时间,假设电解时温度不变且使用惰性电极,下列说法正确的是( )
| A、当电池正极消耗mg气体时,电解池阳极同时有mg气体生成 | ||||
| B、电池的正极反应式为:O2+2H2O+4e-=4OH- | ||||
C、电解后
| ||||
| D、电解一段时间,若想恢复Na2CO3原浓度,只需要加入水即可 |
将10.4g两种金属的混合物投入足量的盐酸中,反应完全后,得到氢气5.6L(标准状况),该混合物的组成可能是( )
| A、钙和镁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
混合下列各组物质使之充分反应,加热蒸干产物并在300摄氏度灼烧至质量不变,最终残留固体为纯净物的是( )
| A、向以物质的量1:1混合的Cu、Fe2O3混合物中加入过量的盐酸 |
| B、以物质的量1:2混合的在(NH4)2SO4与BaCl2溶液 |
| C、以物质的量2:1混合的NaHCO3与Na2O2固体 |
| D、以物质的量2:1混合的MgBr2和氯气反应后的产物 |
下列说法正确的是( )
| A、SiO2是酸性氧化物,不与任何酸反应 |
| B、物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者 |
| C、高温时SiO2和Na2CO3反应放出CO2,说明硅酸的酸性比碳酸强 |
| D、水玻璃敞口存放,会有沉淀析出 |