题目内容
下列说法正确的是( )
| A、SiO2是酸性氧化物,不与任何酸反应 |
| B、物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者 |
| C、高温时SiO2和Na2CO3反应放出CO2,说明硅酸的酸性比碳酸强 |
| D、水玻璃敞口存放,会有沉淀析出 |
考点:硅和二氧化硅,含硅矿物及材料的应用,钠的重要化合物
专题:元素及其化合物
分析:A.二氧化硅属于酸性氧化物,但和HF反应;
B.物质的量浓度相同的Na2SiO3和Na2CO3溶液,酸根离子水解程度越大,其钠盐溶液pH越大;
C.常温下,强酸能够制取弱酸,据此判断酸性强弱;
D.硅酸钠溶液和二氧化碳反应生成难溶性硅酸.
B.物质的量浓度相同的Na2SiO3和Na2CO3溶液,酸根离子水解程度越大,其钠盐溶液pH越大;
C.常温下,强酸能够制取弱酸,据此判断酸性强弱;
D.硅酸钠溶液和二氧化碳反应生成难溶性硅酸.
解答:
解:A.二氧化硅属于酸性氧化物,但和HF反应生成SiF4,故A错误;
B.物质的量浓度相同的Na2SiO3和Na2CO3溶液,酸根离子水解程度越大,其钠盐溶液pH越大,酸根离子水解程度SiO 32->CO 32-,所以物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者,故B正确;
C.高温下,二氧化硅能和碳酸钠反应,不能说明碳酸酸性小于硅酸,要根据常温下,强酸制取弱酸判断,故C错误;
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,所以水玻璃敞口存放,会有沉淀析出,故选BD.
B.物质的量浓度相同的Na2SiO3和Na2CO3溶液,酸根离子水解程度越大,其钠盐溶液pH越大,酸根离子水解程度SiO 32->CO 32-,所以物质的量浓度相同的Na2SiO3和Na2CO3溶液,其PH值前者大于后者,故B正确;
C.高温下,二氧化硅能和碳酸钠反应,不能说明碳酸酸性小于硅酸,要根据常温下,强酸制取弱酸判断,故C错误;
D.Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓,所以水玻璃敞口存放,会有沉淀析出,故选BD.
点评:本题考查物质的性质,侧重考查学生分析问题、解答问题能力,熟练掌握元素化合物知识,注意:二氧化硅性质的特殊性,为易错点,题目难度不大.

练习册系列答案
相关题目
将两个铂电极插入500mL CuSO4溶液中进行电解,通电一定时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化).此时溶液中氢离子浓度约为( )
| A、4×l0-3 mol/L |
| B、2×l0-3 mol/L |
| C、1×l0-3 mol/L |
| D、1×l0-7 mol/L |
将盛有1mol NO和NO2的混合气体的试管倒立于水槽中,再通入0.4mol O2,充分反应后,水便会充满整个试管.则原混合气体中NO与NO2体积比为( )
| A、1:2 | B、2:5 |
| C、3:7 | D、无法确定 |
50mL三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来状态(常温常压),体积缩小100mL,则这三种烃可能是( )
| A、C2H6、C3H6、C4H6 |
| B、CH4、C2H4、C3H4 |
| C、C2H4、C3H6、C3H4 |
| D、CH4、C2H6、C3H8 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | ||
B、常温下的溶液:
| ||
| C、O.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | ||
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
下列能达到实验目的是( )
A、 防倒吸 |
B、 排水法收集NO2 |
C、 实验室制氨气 |
D、 除去杂质气体HCl |
下列关于Na2O和过Na2O2的比较正确的是( )
| A、Na2O和Na2O2都是钠的氧化物,都是碱性氧化物 |
| B、Na2O和Na2O2它们都是白色固体 |
| C、Na2O2与二氧化碳的反应中,Na2O2既是氧化剂又是还原剂 |
| D、1mol Na2O2在和水的反应中,转移的电子数约为:1.204×1024个 |
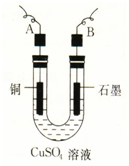 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题: