题目内容
用铂作电极电解1L含有0.4molCuSO4和0.2molNaCl的水溶液,一段时间后在一个电极上得到了0.3molCu,在另一极上析出的气体在标况下的体积是( )
| A、4.48L |
| B、5.6L |
| C、6.72L |
| D、13.44L |
考点:电解原理
专题:电化学专题
分析:电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol<0.4mol,根据转移电子守恒计算阳极上生成气体体积.
解答:
解:电解硫酸铜和氯化钠溶液时,阳极上氯离子先放电,然后氢氧根离子放电,阴极上铜离子放电,后氢离子放电,当阴极上析出析出铜的物质的量为0.3mol,阴极上转移电子的物质的量=0.3mol×2=0.6mol,
根据原子守恒知,溶液中n(Cl-)=0.2mol,氯离子完全放电时转移电子的物质的量=0.2mol×1=0.2mol,生成氯气0.1mol;
所以阳极上有氧气生成,电极上电子转移为0.4mol,4OH--4e-=2H2O+O2↑,电极反应计算生成氧气0.1mol,所以阳极生成气体物质的量为0.2mol,标准状况下气体的体积为4.48L,
故选A.
根据原子守恒知,溶液中n(Cl-)=0.2mol,氯离子完全放电时转移电子的物质的量=0.2mol×1=0.2mol,生成氯气0.1mol;
所以阳极上有氧气生成,电极上电子转移为0.4mol,4OH--4e-=2H2O+O2↑,电极反应计算生成氧气0.1mol,所以阳极生成气体物质的量为0.2mol,标准状况下气体的体积为4.48L,
故选A.
点评:本题考查了电解原理,明确阴阳极上离子放电顺序是解本题关键,注意要首先根据转移电子相等判断阳极上生成气体成分,再计算其体积,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
互为同素异形体的一组物质是( )
| A、16 8O和18 8O |
| B、O2和O3 |
| C、CH≡CH和CH2=CH2 |
D、CH3CH2CH2CH3和 |
NO与NO2的混合气体60ml,通入水中,最后收集到的气体体积为40ml(气体体积均在相同条件下测定),则原混合气体中NO与NO2的体积比为( )
| A、1:2 | B、2:3 |
| C、3:2 | D、1:1 |
化学与科技、社会、生产密切结合,下列有关说法不正确的是( )
| A、“乙醇汽油”的广泛使用能有效减少有害气体的排放 |
| B、向鸡蛋白溶液中缓慢加入饱和(NH4)2SO4溶液有沉淀产生属于物理变化 |
| C、“无氟冰箱”取代“含氟冰箱”,对臭氧层起到了保护作用 |
| D、从油菜籽中提取的生物柴油与从石油炼制得到的柴油都属于烃类物质 |
将盛有1mol NO和NO2的混合气体的试管倒立于水槽中,再通入0.4mol O2,充分反应后,水便会充满整个试管.则原混合气体中NO与NO2体积比为( )
| A、1:2 | B、2:5 |
| C、3:7 | D、无法确定 |

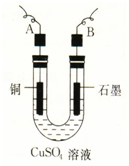 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题: