题目内容
将10.4g两种金属的混合物投入足量的盐酸中,反应完全后,得到氢气5.6L(标准状况),该混合物的组成可能是( )
| A、钙和镁 | B、镁和铜 |
| C、铝和镁 | D、锌和铁 |
考点:有关混合物反应的计算
专题:计算题
分析:假设金属为+2价,根据电子转移守恒计算金属物质的量,再根据
=
计算平均相对原子质量,平均相对原子质量应介于各组分之间,若金属不反应生成氢气,可以视作其相对原子质量为无穷大.
. |
| M |
| m总 |
| n总 |
解答:
解:标况下,5.6L氢气物质的量为
=0.25mol,
假设金属为+2价,根据电子转移守恒可知金属总物质的量为0.25mol,
故金属平均相对原子质量为
=41.6,
A.Ca相对原子质量为40,Mg相对原子质量为24,均小于41.6,不符合题意,故A错误;
B.Mg相对原子质量为24,Cu不反应,可以视作其相对原子质量为无穷大,符合题意,故B正确;
C.若Al为+2价,相对原子质量为27×
=18,Mg相对原子质量为24,均小于41.6,不符合题意,故C错误;
D.Zn相对原子质量为65,Fe相对原子质量为56,均大于41.6,不符合题意,故D错误,
故选B.
| 5.6L |
| 22.4L/mol |
假设金属为+2价,根据电子转移守恒可知金属总物质的量为0.25mol,
故金属平均相对原子质量为
| 10.4 |
| 0.25 |
A.Ca相对原子质量为40,Mg相对原子质量为24,均小于41.6,不符合题意,故A错误;
B.Mg相对原子质量为24,Cu不反应,可以视作其相对原子质量为无穷大,符合题意,故B正确;
C.若Al为+2价,相对原子质量为27×
| 2 |
| 3 |
D.Zn相对原子质量为65,Fe相对原子质量为56,均大于41.6,不符合题意,故D错误,
故选B.
点评:本题考查混合物计算,难度中等,注意利用平均值进行解答,也可以利用极限法计算需要各金属的质量等方法判断.

练习册系列答案
相关题目
化学与科技、社会、生产密切结合,下列有关说法不正确的是( )
| A、“乙醇汽油”的广泛使用能有效减少有害气体的排放 |
| B、向鸡蛋白溶液中缓慢加入饱和(NH4)2SO4溶液有沉淀产生属于物理变化 |
| C、“无氟冰箱”取代“含氟冰箱”,对臭氧层起到了保护作用 |
| D、从油菜籽中提取的生物柴油与从石油炼制得到的柴油都属于烃类物质 |
下列叙述正确的是( )
| A、电解精炼金属时,含杂质的粗金属做阳极,与电源正极相连 |
| B、电解池中金属导线中电子由电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极 |
| C、在电解池中,电解质溶液中的阴离子向阴极移动,阳离子向阳极移动 |
| D、在电解精炼金属过程中,电解质溶液的成分不发生任何变化 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO42- | ||
B、常温下的溶液:
| ||
| C、O.1 mol/L AgNO3溶液:H+、K+、SO42-、I- | ||
| D、加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |
 向某碳酸钠溶液中逐滴加1mol?L─1的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2
向某碳酸钠溶液中逐滴加1mol?L─1的盐酸,测得溶液中Cl-、HCO3-的物质的量随加入盐酸体积的关系如图所示,其中n2:n1=3:2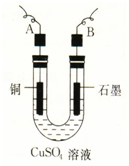 某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题:
某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m g)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,所用部分仪器及装置如图所示,回答下列问题: