题目内容
6.下列有关物质的表述中正确的是( )| A. | 18O的原子结构示意图: | B. | 中子数为8的氮原子:${\;}_{8}^{15}$N | ||
| C. | 次氯酸的电子式: | D. | NH4+的结构式: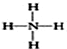 |
分析 A、18O原子的核内有个质子,核外有8个电子;
B、氮原子有7个质子,故中子数为8的氮原子的质量数为7+8=15;
C、HClO中H原子和O原子、O原子和Cl原子间均有一对共用电子对;
D、铵根离子结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,箭头指向氢.
解答 解:A、18O原子的核内有个质子,核外有8个电子,故18O原子结构示意图为 ,故A正确;
,故A正确;
B、氮原子有7个质子,故中子数为8的氮原子的质量数为7+8=15,故氮原子为157N,故B错误;
C、次氯酸为共价化合物,H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,则其电子式为: ,故C错误;
,故C错误;
D、NH4+结构中氮原子和氢原子间的配位键是氮原子提供孤对电子,其结构式为: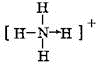 ,故D错误.
,故D错误.
故选A.
点评 本题考查了了电子式、结构式、等化学用语的书写,题目难度中等,注意掌握常见化学用语的概念及书写原则,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
相关题目
16.研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.CO可用于炼铁,
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,
C(s)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1;则CO还原Fe2O3(s)的热化学方程式为( )
| A. | Fe2O3+3CO=2Fe+3CO2△H=-28.5kJ•mol-1( ) | |
| B. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ | |
| C. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=+28.5kJ•mol-1 | |
| D. | Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ•mol-1. |
17.下列各组微粒的空间构型相同的是( )
| A. | BF3和CCl4 | B. | CO2和BeCl2 | C. | NH4+和H3O+ | D. | O3和SO3 |
1.下列有机化合物的一氯取代物的同分异构体的数目相等的是( )


| A. | ①② | B. | ②④ | C. | ③④ | D. | ①④ |
11.下列化学用语正确的是( )
| A. | HCl的电子式 | B. | Cl-的结构示意图 | ||
| C. | CO2的电子式 | D. | 质量数为37的氯原子37Cl |
18.按电子排布,可把周期表里的元素划分成5个区,以下元素属于p区的是( )
| A. | Fe | B. | Mg | C. | Br | D. | Cu |
16.已知A、B、C、D的原子序数都不超过18,它们的离子aAm+、bBn+、cCm-、dDn- (m>n)均具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:aAm+>bBn+>cCm->dDn- | |
| C. | 离子还原性:aA(n+1)+>bBn+,离子氧化性:cCm->dDn- | |
| D. | 单质还原性:B>A,单质氧化性:D>C |
 工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示
工业上合成甲醇的反应为:CO(g)+2H2(g)?CH3OH(g)△H<0.500℃,5MPa条件下,将0.20mol CO与0.58mol H2的混合气体充入2L恒容密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示