题目内容
5.下列各元素的性质或原子结构递变规律错误的是( )| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素的最高正价依次升高 | |
| C. | Li、Na、K的金属性依次减弱 | |
| D. | N、O、F原子半径依次增大 |
分析 A.Li、Be、B位于同周期,从左向右原子序数增大;
B.P、S、Cl位于同周期,从左向右原子序数增大;
C.Li、Na、K位于同主族,从上到下金属性增强;
D.N、O、F位于同周期,从左向右原子序数增大.
解答 解:A.Li、Be、B位于同周期,从左向右原子序数增大,则最外层电子数依次增多,故A正确;
B.P、S、Cl位于同周期,从左向右原子序数增大,则元素的最高正价依次升高,故B正确;
C.Li、Na、K位于同主族,从上到下金属性增强,则Li、Na、K的金属性依次增强,故C错误;
D.N、O、F位于同周期,从左向右原子序数增大,则原子半径依次减小,故D错误;
故选CD.
点评 本题考查元素周期表和周期律,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
16.锰及其化合物在生产、生活中有许多用途.
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图1:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
(1)“酸浸”中MnO2反应的离子方程式为MnO2+2Fe2++4H+$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Fe3++2H2O;滤渣I的成分是SiO2.
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O或Mn2++HCO3-+NH3=MnCO3↓+NH4+.
(4)以Mn2O3和金属铝为原料可以制备粗锰,写出化学反应方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
II.科学家发明了NH3燃料电池,以KOH为电解质,原理如图2所示.
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
I.在实验室中模拟工业利用软锰矿(主要成分为MnO2,含少量SiO2、Fe2O3和A12O3等)制备金属锰等物质,设计流程如图1:

己知:碳酸锰在空气中高温加热固体产物为Mn2O3;部分氢氧化物的Ksp(近似值)如表.
| 物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 |
| Ksp | 10-13 | 10-17 | 10-39 | 10-33 |
(2)向滤液I 中滴加双氧水的目的是将Fe2+氧化为Fe3+,便于转化为Fe(OH)3除去;测得滤液I 中c(Mn2+)=0.1mol•L-1,为保证滴加氨水不产生Mn(OH)2,应控制溶液pH最大为8.
(3)“沉锰”过程中的离子方程式为Mn2++HCO3-+NH3•H2O=MnCO3↓+NH4++H2O或Mn2++HCO3-+NH3=MnCO3↓+NH4+.
(4)以Mn2O3和金属铝为原料可以制备粗锰,写出化学反应方程式Mn2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Mn.
II.科学家发明了NH3燃料电池,以KOH为电解质,原理如图2所示.
(5)该燃料电池的负极反应式为2NH3+6OH--6e-=N2+6H2O.
17.某烃的键线式结构为 ,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
 ,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )
,该烃与Br2按物质的量之比为1:1加成时,所得产物有(不考虑立体异构)( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
14.25℃时,某溶液中由水电离产生的C(H+)和C(OH-)的乘积为1×10-20,下列说法正确的是( )
| A. | 该溶液的pH不可能是7 | B. | 该溶液的pH一定是4 | ||
| C. | 该溶液的pH一定是10 | D. | 不会有这样的溶液 |
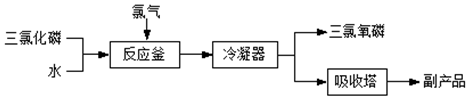
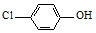 )的废水可以利用微生物电池除去,其原理如图1所示.
)的废水可以利用微生物电池除去,其原理如图1所示.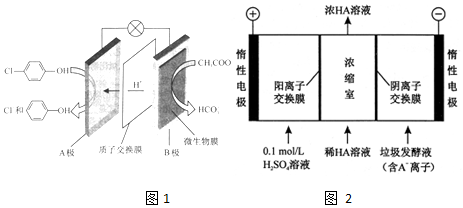
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-
-OH+Cl-

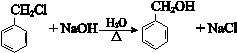 .
.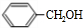 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2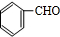 +2H2O.
+2H2O. .
.