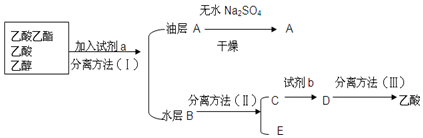
题目内容
15. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).
分析 (1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,9min后各物质的物质的量不再变化,且反应物不为0,
(2)根据物质的量的变化得出反应物和生成物,再根据物质的量变化量之比等于化学计量数之比,得到化学方程式;
(3)依据化学反应速率=$\frac{△c}{△t}$,结合图表数据计算;
(4)根据转化率等于变化量和初始量的比值计算反应物X的转化率;
(5)相同条件下气体的体积之比等于物质的量之比,根据平衡时各组分的浓度计算Z的体积分数.
解答 解:(1)由表中数据可知,X、Y为反应物,Z为生成物,1min时△n(X)=1mol-0.9mol=0.1mol,△n(Y)=1mol-0.8mol=0.2mol,△n(Z)=0.2mol,所以X、Y、Z在相同时间内的变化量之比为1:2:2,9min后各物质的物质的量不再变化,平衡时X、Y、Z的物质的量分别为:0.55mol、0.1mol、0.9mol.
横坐标为时间,从坐标为X、Z的物质的量(n),根据表中数据可画出曲线为: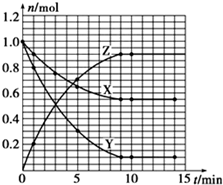 ,
,
故答案为: ;
;
(2)由表中数据看出反应从开始到平衡,X的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.90mol=0.10mol,Y的物质的量减小,应为反应物,0~1min物质的量变化值为1.00mol-0.80mol=0.20mol,Z的物质的量增多,应为是生成物,物质的量的变化值为0.20mol,9min后各物质的物质的量不再变化,且反应物不为0,故为可逆反应,根据物质的量的变化与化学计量数呈正比,则n(X):n(Y):n(Z)=0.10mol:0.20mol:0.20mol=1:2:2,反应方程式为:X(g)+2Y(g)?2Z(g),
故答案为:X(g)+2Y(g)?2Z(g);
(3)0-3min内Z的物质的量变化为0.5mol,则反应在0~3min时间内v(Z)=$\frac{\frac{0.5mol}{2L}}{3min}$=0.083mol/(L•min),
故答案为:0.083mol/(L•min);
(4)平衡时X的物质的量为0.90mol,X的初始物质的量为1.0mol,则该反应达到平衡时反应物X的转化率为:$\frac{1.0mol-0.55mol}{1.0mol}$×100%=45%,
故答案为:45%;
(5)平衡时Z的物质的量为0.55mol,气体总物质的量为:0.55mol+0.10mol+0.90mol=1.55mol,
相同条件下气体体积分数等于物质的量分数,则平衡时Z的体积分数为:$\frac{0.55mol}{1.55mol}$×100%≈58%,
故答案为:58%.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡的特征为解答关键,注意掌握化学反应速率、转化率、体积分数的概念及表达式,试题培养了学生的分析能力及化学计算能力.

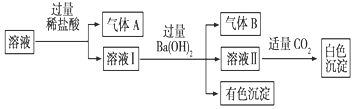 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
Ⅰ.C(s)+O2(g)═CO2(g)△H1<0
Ⅱ.C(s)+H2O(g)═CO(g)+H2(g)△H2>0
2CO(g)+O2(g)=2CO2(g△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0请回答:
(1)途径Ⅰ放出的热量=途径Ⅱ放出的热量(填“>”、“<”或“=”).
(2)△H1、△H2、△H3、△H4之间关系的数学表达式是△H1=△H2+$\frac{1}{2}$(△H3+△H4)
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①在一个温度恒定固定容积的密闭容器中发生上述反应,反应达到平衡的标志是cd
(填序号)
a.体系的压强不再改变 b.体系的密度不再改变 c.各气体的浓度不再改变
d.各气体的质量分数不再改变 e.反应速率v(CO):v(H2)=1:1
②上述反应的正反应是放热反应(填“放热”或“吸热”);
400℃时反应H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数数值是0.1;
③830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)发生反应,10分钟达到平衡,此10分钟内用H2表示的平均反应速率是0.12mol/(L•min);达到平衡时CO的转化率是60%.
(4)汽车尾气净化中的一个反应如:
NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ/mol
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是C

①2Fe2O3(s)+3C(s)?4Fe(s)+3CO2(g)△H=+460.5KJ•mol-1
②Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=-28.5KJ•mol-1
③断裂1mol CO(s)气体中的化学键需要吸收1076KJ的能量
断裂1mol CO2(s)气体中的化学键需要吸收1490KJ的能量
请回答:
(1)断裂1mol C(s)中所有化学键需要吸收的能量为834.5kJ.
(2)T1℃时,向密闭容器中加入一定量的Fe2O3和C,发生反应①,达到平衡后,CO2的浓度为a mol•L-1;其他条件不变,缩小容器容积,再次达到平衡时,CO2的浓度为b mol•L-1,则a=(选填“>”“<”或“=”)b.
(3)起始温度均为T2℃时,向容积为10L的三个恒容密闭容器中,分别加入一定量的Fe2O3和CO发生反应②,测得相关数据如表所示:
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
②容器2中,5min达到平衡,则0~5min内以CO2表示该反应的速率v(CO2)=0.048mol/(L•min).
③对于三个容器中的反应,下列说法正确的是D(填选项字母).
A.m>2n
B.容器1和容器2中CO的平衡转化率v1<v2.
C.K1=K3
D.平衡时气体压强:P3>P1
(4)T2℃时,向恒压密闭容器中充入0.5mol Fe2O3和1.0mol CO,发生反应②,CO和CO2的物质的量浓度(c)与时间(t)的关系如图1所示.
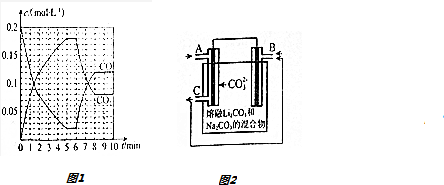
①6min时,改变的外界条件未升温,理由为升温,平衡逆向移动,CO浓度增大,CO2浓度减小.
②10min时,再向容器中加入1 mol Fe2O3、1 mol CO、1 mol Fe、1 mol CO2、起始的反应速率v(正)<(选填“>”“<”或“=”)v(逆).
(5)CO-O2熔融盐燃料电池的装置如图2所示,电池工作时,C口产生的气体一部分通入B口被利用,另一部分被分离出来,若导线中流过2mole-,理论上C口被分离出的气体的物质的量最多为1mol.
 可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯
可与甲醇充分反应,反应后有机产物的名称为:对苯二甲酸二甲酯 .
. ,
,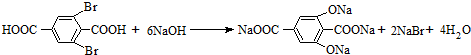 .
.