题目内容
7.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.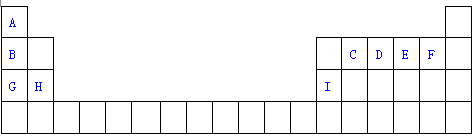
试回答下列问题:
(1)请写出H的单质与二氧化碳反应的方程式2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
(2)D的气态氢化物的VSEPR模型为四面体,其中心原子的杂化类型为sp3杂化.
(3)G、H和I的第一电离能数值由大到小的顺序为:Mg>Al>Na(用元素符号作答).
(4)由A、C、D形成的ACD分子中,含有2个σ键,2个π键.
分析 由元素在周期表中的位置可知,A为H,R为He,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Mg,I为Al,
(1)Mg与二氧化碳反应生成MgO和C;
(2)D的气态氢化物为氨气;
(3)金属活泼性越强,第一电离能越小,但Mg的最外层s电子全满,为稳定结构,则第一电离能最大;
(4)由A、C、D形成的ACD分子为H-C≡N,单键为σ键,三键中有1个σ键、2个π键.
解答 解:由元素在周期表中的位置可知,A为H,R为He,B为Li,C为C,D为N,E为O,F为F,G为Na,H为Mg,I为Al,
(1)Mg与二氧化碳反应生成MgO和C,该反应为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)D的气态氢化物为氨气,有1对孤对电子和3个σ键,VSEPR模型为四面体,空间构型为三角锥型,N原子采取sp3杂化,故答案为:四面体;sp3杂化;
(3)金属活泼性越强,第一电离能越小,但Mg的最外层s电子全满,为稳定结构,则第一电离能最大,所以第一电离能为Mg>Al>Na,故答案为:Mg>Al>Na;
(4)由A、C、D形成的ACD分子为H-C≡N,单键为σ键,三键中有1个σ键、2个π键,则分子中共有2个σ键、2个π键,故答案为:2;2.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、性质、分子构型及杂化、第一电离能为解答的关键,侧重分析与应用能力的考查,注意原子结构与性质的应用,题目难度不大.

练习册系列答案
相关题目
6.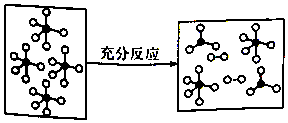 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为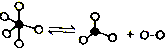 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
15. 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是X(g)+2Y(g)?2Z(g).
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).
2. 碳及其化合物应用广泛.
碳及其化合物应用广泛.
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图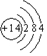 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
则该温度下反应的平衡常数K=1
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
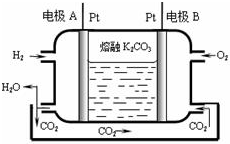
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
 碳及其化合物应用广泛.
碳及其化合物应用广泛.I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:
CO(g)+H2O(g)$\stackrel{沸石分子筛}{?}$CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图
 (2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.
(2)向1L恒容密闭容器中注人CO和H2O(g),830℃时测得部分数据如表.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
(3)相同条件下,向1L恒容密闭容器中,同时注人1m o l CO、1mol H2O (g),2molCO2和2mo1H2,此时v(正 )< v(逆)(填“>”“=”或“<”)
II.已知CO(g)+$\frac{1}{2}$O2 (g)= CO2 (g)△H=-141kJ•mol-1
2H2 (g)+O2(g)= 2H2o (g)△H=-484kJ•mol-1
CH3OH(1)+$\frac{3}{2}$O2(g)=CO2 (g)+2H2O (g)△H=-726kJ•mol-1'
(4)利用CO、H2化合制得液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=+101kJ/mol
III.一种新型氢氧燃料电池工作原理如图所示
(5)写出电极A的电极反应式H2-2e-+CO32-=CO2+H2O
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通入O2的体积为2.24L(标准状况)
12. 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变红色,说明SO2呈酸性 | |
| B. | 品红溶液褪色,说明SO2具有漂白性 | |
| C. | 溴水橙色褪去,体现了SO2的还原性 | |
| D. | 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应 |
19.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+具有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸具有脱水性和强氧化性 | 浓硫酸滴到湿润的蔗糖中,蔗糖变成黑色海绵状 |
| C | SiO2有导电性 | SiO2可用于制备光导纤维 |
| D | 铝制品在空气中耐腐蚀 | 铝是不活泼金属 |
| A. | A | B. | B | C. | C | D. | D |
17.有四种有机物①(CH3)2CHCH(CH3)2,②(CH3)2C(CH3)2,③CH3(CH2)2CH(CH3)2,④CH3CH2C(CH3)3 有关四种物质的下列叙述中正确的是( )
| A. | 能通过加氢反应得到③的烯烃有四种 | |
| B. | ①和②互为同分异构体,①和④互为同系物 | |
| C. | ②可以由烯烃与氢气加成而获得 | |
| D. | ④的一氯代物有四种 |
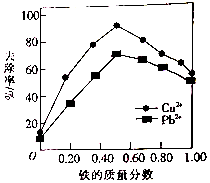 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
 .
.