题目内容
3.煤作为燃料有两种途径:Ⅰ.C(s)+O2(g)═CO2(g)△H1<0
Ⅱ.C(s)+H2O(g)═CO(g)+H2(g)△H2>0
2CO(g)+O2(g)=2CO2(g△H3<0
2H2(g)+O2(g)═2H2O(g)△H4<0请回答:
(1)途径Ⅰ放出的热量=途径Ⅱ放出的热量(填“>”、“<”或“=”).
(2)△H1、△H2、△H3、△H4之间关系的数学表达式是△H1=△H2+$\frac{1}{2}$(△H3+△H4)
(3)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题.
已知CO(g)+H2O(g)?H2(g)+CO2(g)的平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
①在一个温度恒定固定容积的密闭容器中发生上述反应,反应达到平衡的标志是cd
(填序号)
a.体系的压强不再改变 b.体系的密度不再改变 c.各气体的浓度不再改变
d.各气体的质量分数不再改变 e.反应速率v(CO):v(H2)=1:1
②上述反应的正反应是放热反应(填“放热”或“吸热”);
400℃时反应H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数数值是0.1;
③830℃时,在2L的密闭容器中加入4mol CO(g)和6mol H2O(g)发生反应,10分钟达到平衡,此10分钟内用H2表示的平均反应速率是0.12mol/(L•min);达到平衡时CO的转化率是60%.
(4)汽车尾气净化中的一个反应如:
NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g)△H=-373.4kJ/mol
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是C

分析 (1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量;
(2)由盖斯定律,将途径Ⅱ的三个化学方程式乘以适当的系数进行加减,反应热也乘以相应的系数进行相应的加减,构造出途径I的热化学方程式,据此判断△H1、△H2、△H3、△H4的数学关系式;
(3)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化;
②温度升高,平衡常数减小,说明平衡逆向移动;相同温度下CO(g)+H2O(g)?H2(g)+CO2(g)与H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数互为倒数;
③依据平衡三段式列式计算反应的一氧化碳以及生成的氢气的物质的量,进而可计算反应速率以及转化率;
(4)A.平衡常数只受温度影响,升高温度平衡向吸热反应移动,该反应正反应为放热反应,故升高温度平衡向逆反应移动.
B.该反应正反应为放热反应,升高温度平衡向逆反应移动,CO的转化率降低.
C.平衡常数只受温度影响,温度不变平衡常数不变,与物质的浓度无关.
D.增大氮气的物质的量,氮气的浓度增大,平衡向逆反应移动.
解答 解:(1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量,
故答案为:=;
(2)途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0 ①
途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0 ③
2H2(g)+O2 (g)═2H2O(g)△H4<0 ④
由盖斯定律可知,②×2+③+④得2C(s)+2O2 (g)═2CO2(g)△H=2△H2+△H3+△H4,
所以△H1=$\frac{1}{2}$△H=$\frac{1}{2}$(2△H2+△H3+△H4)=△H2+$\frac{1}{2}$(△H3+△H4),
故答案为:△H1=△H2+$\frac{1}{2}$(△H3+△H4);
(3)①a.反应前后体积不变,则无论是否达到平衡状态,体系的压强都不改变,故a错误;
b.气体的质量不变,容器的体积不变,则无论是否达到平衡状态,体系的密度都不改变,故b错误;
c.各气体的浓度不再改变,可说明达到平衡状态,故c正确;
d.各气体的质量分数不再改变,可说明达到平衡状态,故d正确;
e.反应速率之比等于化学计量数之比,反应速率v(CO):v(H2)=1:1,不能说明达到平衡状态,故e错误.
故答案为:cd;
②温度升高,平衡常数减小,说明平衡逆向移动,则正反应为放热反应,相同温度下CO(g)+H2O(g)?H2(g)+CO2(g)与H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数互为倒数,则400℃时反应H2(g)+CO2(g)?CO(g)+H2O(g)的化学平衡常数数值是0.1,
故答案为:放热;0.1;
③830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,设一氧化碳转化物质的量为x,依据平衡三段式列式得到
CO(g)+H2O(g)?H2(g)+CO2(g)
起始量(mol) 4 6 0 0
变化量(mol) x x x x
平衡量(mol) 4-x 6-x x x
平衡常数K=$\frac{{x}^{2}}{(4-x)(6-x)}$=1,
x=2.4mol,
v(H2)=$\frac{\frac{2.4mol}{2L}}{10min}$=0.12mol/(L•min),
CO的转化率=$\frac{2.4mol}{4mol}$×100%=60%
故答案为:0.12mol/(L•min);60%;
(4)A.平衡常数只受温度影响,升高温度平衡向吸热反应移动,该反应正反应为放热反应,故升高温度平衡向逆反应移动,平衡常数降低,故A错误;
B.该反应正反应为放热反应,升高温度平衡向逆反应移动,CO的转化率降低,故B错误;
C.平衡常数只受温度影响,温度不变平衡常数不变,与物质的浓度无关,增大NO的物质的量,不影响平衡常数,故C正确;
D.增大氮气的物质的量,氮气的浓度增大,平衡向逆反应移动,NO的转化率降低,故D错误.
故答案为:C.
点评 本题考查了化学平衡的计算,题目难度中等,明确影响化学平衡的因素为解答关键,注意掌握三段式在化学平衡的计算中的应用,试题培养了学生的分析能力及化学计算能力.

 阅读快车系列答案
阅读快车系列答案进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色.下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 | |
| C. | 步骤Ⅱ中无色气体是NO气体 | |
| D. | 原溶液中肯定含有K+、Fe2+、NO3-、SO42- |
| A. | 分子式为C5H11Cl的有机物有8种同分异构体 | |
| B. | 塑料的老化是因为其主要成分在空气中发生了缓慢的加成反应 | |
| C. | 乙醇和乙酸都能与碳酸氢钠溶液反应 | |
| D. | 富含糖类和蛋白质的物质都易被人体消化 |
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$ CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g) $\frac{\underline{\;催化剂\;}}{高温}$ CO(g)+3H2(g)
已知有关反应的能量变化如图,且方法②的反应只能在高温下发生,则方法②中反应的△H=a+3b-c kJ/moL.

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g) $?_{催化剂}^{高温、高压}$2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol•L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g•L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t>5min (填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率0.2mol•L-1•min-1(注明单位).
(4)分析上表数据,下列关系正确的是c.
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=$\frac{4}{81}$(用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3•H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10 mol•L-1,则NH3•H2O的电离平衡常数K=1.80×10-5mol•L-1(保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是:c(NH4+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
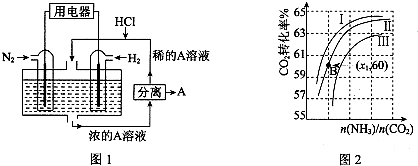
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示.
电池正极的电极反应式是N2+6e-+8H+=2NH4+,A是NH4Cl.
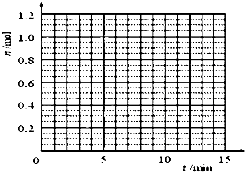
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图2表示CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是Ⅲ.
②测得B点氨的转化率为40%,则x13.
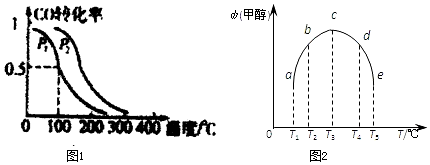
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).
 如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )
如图是研究二氧化硫性质的微型实验装置.现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气.下列说法中错误的是( )| A. | 紫色石蕊溶液变红色,说明SO2呈酸性 | |
| B. | 品红溶液褪色,说明SO2具有漂白性 | |
| C. | 溴水橙色褪去,体现了SO2的还原性 | |
| D. | 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应 |
| A. | CuCl2 | B. | FeCl3 | C. | MgSO4 | D. | BaCl2 |
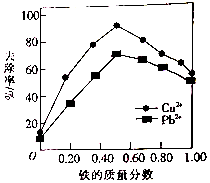 铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.
铁炭混合物(铁屑和活性炭的混合物)、纳米铁粉均可用于处理水中污染物.在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示.已知活性炭对重金属离子具有一定的吸附作用.