题目内容
14.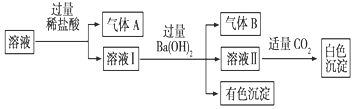 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
分析 溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,结合实验流程可知,与盐酸反应生成A为二氧化碳或NO,则可能含CO32-或Fe2+、NO3-,溶液I与氢氧化钡反应生成气体B为氨气,有色沉淀为氢氧化铁,则一定含Fe2+、NH4+、NO3-,由离子共存可知,一定不含CO32-;溶液II与二氧化碳反应生成白色沉淀为碳酸钡,可能含氢氧化铝,存在的各离子具有相同的物质的量,由电荷守恒可知,不含Na+、Al3+,一定含SO42-,以此来解答.
解答 解:由上述分析可知,一定含Fe2+、NO3-、NH4+、SO42-,一定不含CO32-、Na+、Al3+,白色沉淀为碳酸钡,气体A为NO,气体B为氨气,只有C符合,
故选C.
点评 本题考查常见离子的推断,为高频考点,把握亚铁离子与硝酸根离子的反应、有色沉淀和白色沉淀、电荷守恒为解答的关键,侧重分析与推断能力的考查,注意发生的氧化还原反应及离子共存应用,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质性质的比较中,正确的是( )
| A. | 氧化性:Br2>Cl2 | B. | 稳定性:HF>HCl | ||
| C. | 碱性:Mg(OH)2>NaOH | D. | 酸性:H2SiO3>H2SO4 |
5.现有下列4组物质:
A.H2 I2 O2 Al
B.N2 Fe Cu Zn
C.CaO MgO SO2 CuO
D.HCl NH3 H2SO4 HNO3
A.H2 I2 O2 Al
B.N2 Fe Cu Zn
C.CaO MgO SO2 CuO
D.HCl NH3 H2SO4 HNO3
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属单质 | 金属单质 | 金属氧化物 | 酸 |
| 不属于该类的物质 | Al | N2 | SO2 | NH3 |
19.下列化学用语的描述不正确的是( )
| A. | 烧碱的分子式为NaOH | |
| B. | 中子数为15的硅原子:${\;}_{14}^{20}$Si | |
| C. | 乙醇的结构简式:C2H5OH | |
| D. | NH3•H2O的电离方程式:NH3•H2O?NH4++OH- |
6.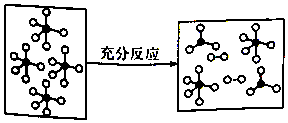 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
 一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )
一定条件下,某容器中各微粒在反应前后变化示意图如图,其中“o”和“•”代表不同元素的原子.下列关于此反应的说法不正确的是( )| A. | 该反应可表示为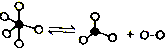 | |
| B. | 可能是PCl5的分解反应 | |
| C. | 反应过程中,一定伴随共价键的断裂与形成 | |
| D. | 该反应的△H>0 |
3.某溶液中含K+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-、SiO32-、I-中的若干种,某同学欲探究该溶液的组成,
进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色.下列说法正确的是( )
进行如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰.
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成.
Ⅲ.取Ⅱ反应后的溶液分别置于两支试管中,第一支试管中加入BaCl2溶液,有白色沉淀生成,再滴加KSCN溶液,上层清液变红;第二支试管中加入CCl4,充分振荡静置后溶液分层,下层为无色.下列说法正确的是( )
| A. | 原溶液中肯定不含Fe2+、NO3-、SiO32-、I- | |
| B. | 为确定是否含有Cl-,可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀 | |
| C. | 步骤Ⅱ中无色气体是NO气体 | |
| D. | 原溶液中肯定含有K+、Fe2+、NO3-、SO42- |
15.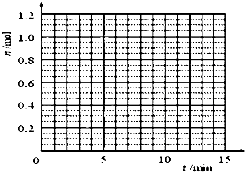 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
(2)体系中发生反应的化学方程式是X(g)+2Y(g)?2Z(g).
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).
 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.
某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示.(1)根据表中数据,在图1中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |
(3)计算该反应在0~3min时间内v(Z)=0.083mol/(L•min)(保留至小数点后三位).
(4)该反应达到平衡时,反应物X的转化率等于45%.
(5)该反应达到平衡时,Z的体积分数为58%(保留两位有效数字).