题目内容
15.铬及其化合物在工业上有着广泛的用途,但在生产和使用过程中易产生有毒害的含铬工业废水.I.处理含铬工业废水的常用方法是还原沉淀法,该方法的工艺流程如下:
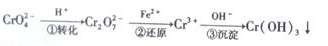
(l)上述流程的步骤①中存在如下平衡:2CrO42-(黄色)+2H+-Cr2072一(橙色)+H20.若平衡体系的pH=0时,溶液的颜色为橙色.
(2)第②步反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,步骤③可通过调节第二步反应后溶液的pH使Cr3+沉淀完全,请通过计算判断当pH>6时,溶液中Cr3+是否沉淀完全:当溶液的pH调节至6时,溶液中c(OH-)=1×10-8mol/L,c(Cr3+)=$\frac{6.0×1{0}^{-31}}{({1×1{0}^{-8})}^{3}}$=6×10-7<10-5mol•L-l,Cr3+沉淀完全.(简要写出计算过程.已知常温下,Cr( OH)3的溶度积Ksp=6.0×10一31,且当溶液中离子浓度小于10 -5mol•L-l时可视作该离子不存在.)
(3)以石墨为电极电解Na2CrO4溶液制取Na2Cr207,电解装置如1图所示.直流电源M极的电极名称是负极,和N相连的一极的电极反应式为4OH--4e-=O2↑+2H2O
Ⅱ.Cr03俗称铬酸酐,常用于制备铬的化合物.Cr03具有强氧化性,热稳定性较差.
(4)Cr03具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火.在硫酸酸化时Cr203可将乙醇氧化成乙
酸,而Cr03被还原成绿色的硫酸铬[Cr2(S04)3].则该反应的化学方程式为4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O.
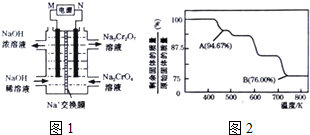
(5)Cr03的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图2所示.请根据图示信息写出从开始加热到750K时总反应的化学方程式4Cr03$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑.
分析 I.(1)根据氢离子对2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O平衡移动的影响判断;
(2)亚铁离子与Cr2O72-发生氧化还原反应,结合Ksp[Cr(OH)3]计算c(Cr3+);
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,则M为负极;
Ⅱ.(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸;
(5)根据质量守恒定律,在变化过程中,Cr的质量没有变,求出氧原子和铬原子的个数比即可,确定生成物可写出反应的方程式.
解答 解:I.(1)若平衡体系的pH=2,溶液酸性较强,平衡2CrO42-(黄色)+2H+═Cr2O72- (橙色)+H2O正向移动,溶液呈橙色,故答案为:橙;
(2)亚铁离子与Cr2O72-发生氧化还原反应,反应的离子方程式为6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;
溶液的pH=6,c(OH-)=1×10-8mol/L,该溶液中c(Cr3+)=$\frac{6.0×1{0}^{-31}}{({1×1{0}^{-8})}^{3}}$=6×10-7<10 -5mol•L-l,Cr3+沉淀完全,
故答案为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;当溶液的pH调节至6时,溶液中c(OH-)=1×10-8mol/L,c(Cr3+)=$\frac{6.0×1{0}^{-31}}{({1×1{0}^{-8})}^{3}}$=6×10-7<10 -5mol•L-l,Cr3+沉淀完全;
(3)根据2CrO42-+2H+?Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,需要通过电解生成H+提高溶液的酸性,说明在该电极是阳极,连接电源的正极,电极反应式为4OH--4e-=O2↑+2H2O,则M为负极,
故答案为:负极;4OH--4e-=O2↑+2H2O;
Ⅱ.(4)CrO3具有强氧化性,遇到有机物(如酒精)时,乙醇被氧化成乙酸,反应的方程式为4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O,
故答案为:4CrO3+3C2H5OH+6H2SO4=2Cr2(SO4)3+3CH3COOH+9H2O;
(5)设固体质量为100g,B点时固体的质量为:100g×76%=76g,Cr的质量没有变,所以生成物中Cr的质量为52g,氧元素的质量为16,两者的个数比为$\frac{52}{52}$:$\frac{24}{16}$=2:3,所以B点时剩余固体的成分是Cr2O3,所以加热到 750K 时成分是Cr2O3,方程式为4Cr03$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑,
故答案为:4Cr03$\frac{\underline{\;\;△\;\;}}{\;}$2Cr2O3+3O2↑.
点评 本题综合考查物质的分离、提纯,侧重于学生的分析、实验和计算能力的考查,题目涉及氧化还原反应的计算、化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,题目难度中等,分析时要根据题给信息,结合相关原理进行解答.

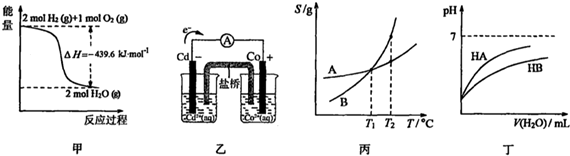
| A. | 由甲可知:氢气的燃烧热为219.8kJ/mol | |
| B. | 由乙可知:盐桥中的Cl-向Cd电极移动 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数:A=B | |
| D. | 由丁可知:同温度、同浓度的NaA溶液与NaB溶液相比,其PH:NaA<NaB |
| A. | 二氧化碳通入过量的氢氧化钠溶液:CO2+2OH-═CO32-+H2O | |
| B. | 碳酸钙与硝酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 少量金属钠放入冷水中:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++H2O═Fe(OH)3↓+3H+ |
| A. | 按系统命名法,有机物 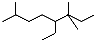 可命名为3,3,7-三甲基-4-乙基辛烷 可命名为3,3,7-三甲基-4-乙基辛烷 | |
| B. | 石油制乙烯、煤的液化、蛋白质的盐析、肥皂去油污均涉及化学变化 | |
| C. | 等质量的乙醇与乙烯完全燃烧,前者生成更多的水 | |
| D. | 全降解塑料 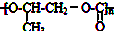 可由环氧丙烷( 可由环氧丙烷(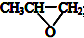 )和CO2反应制得 )和CO2反应制得 |
一定条件下测得反应过程中n(Cl2)的实验数据如下.下列说法正确的是( )
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 增大压强可以提高HCl转化率 | |
| D. | 平衡常数K(200℃)<K(400℃) |
| A. | x<y | B. | x>y | C. | x﹦y | D. | 无法判断 |
| A. | 蛋白质的水解可用于分离和提纯蛋白质 | |
| B. | 丙烯酸甲酯可通过缩聚反应生成高分子化合物 | |
| C. | 有机物 的核磁共振氢谱有两个峰,且峰面积之比为3:1 的核磁共振氢谱有两个峰,且峰面积之比为3:1 | |
| D. | 用乙醇和浓硫酸制备乙烯时,可用水浴加热控制反应的温度 |
| A. | 丙烯 | B. | 1-丁烯 | C. | 1-戊烯 | D. | 3-甲基-2-戊烯 |
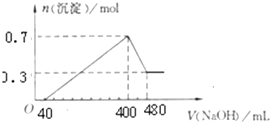 将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算:
将一定质量的Mg和Al混合物投入400mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系;如图所示.计算: