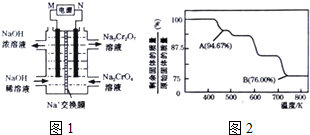
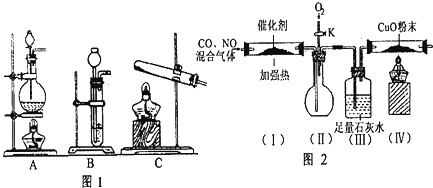
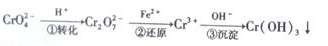题目内容
20.用O2将HCl转化为Cl2,反应方程式为:4HCl(g)+O2(g)?2H2O(g)+2Cl2(g)+Q(Q>0)一定条件下测得反应过程中n(Cl2)的实验数据如下.下列说法正确的是( )
| t/min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A. | 0~2 min的反应速率小于4~6 min的反应速率 | |
| B. | 2~6 min用Cl2表示的反应速率为0.9 mol/(L•min) | |
| C. | 增大压强可以提高HCl转化率 | |
| D. | 平衡常数K(200℃)<K(400℃) |
分析 A.相同时间内氯气物质的量变化越大,说明反应速率越快;
B.根据反应速率的表达式v=$\frac{\frac{△n}{V}}{△t}$进行分析;
C.正反应为气体体积减小的反应,增大压强平衡正向移动;
D.正反应为放热反应,升高温度平衡逆向移动,平衡常数减小.
解答 解:A.相同时间内,0~2min内氯气变化量为1.8×10-3 mol,而4~6min内氯气变化量为(5.4-3.7)×10-3 mol=1.7×10-3 mol,则0~2min的反应速率大于4~6min的反应速率,故A错误;
B.容器容积未知,用单位时间内浓度变化量无法表示氯气反应速率,故B错误;
C.正反应为气体体积减小的反应,增大压强平衡正向移动,可以提高HCl转化率,故C正确;
D.正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,则平衡常数K(200℃)>K(400℃),故D错误,
故选C.
点评 本题化学平衡的计算,题目难度中等,涉及甲醇化学反应速率、化学平衡影响因素、化学平衡常数影响因素等知识,明确化学平衡及其影响为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.当光束通过下列分散系时,可能产生丁达尔效应的是( )
| A. | NaCl溶液 | B. | 氢氧化钠 | C. | 盐酸 | D. | 豆浆 |
8.下列有关说法错误的是( )
| A. | 过氧化氢酶、酚醛树脂、尼龙、有机玻璃、PVC都是高分子化合物 | |
| B. | 分子筛、青花瓷、黏土、硅藻土的主要成分都是硅酸盐 | |
| C. | 植物秸秆发酵制沼气、玉米制乙醇、城市与工业有机废弃物的再利用都涉及生物质能 | |
| D. | 酸碱质子理论进一步扩大了人们对酸碱的认识,可以解释一些非水溶液中进行的酸碱反应 |
5.X元素原子的第二层比Y元素原子的第二层少3个电子,X元素原子核外电子总数比Y元素原子核外电子总数少5个,则X和Y可能形成的化合物是( )
| A. | 离子化合物Y(XO3)2 | B. | 离子化合物Y2X3 | C. | 共价化合物Y3X2 | D. | 共价化合物XY2 |
9.已知NaHCO3溶液呈碱性,在NaHCO3溶液中,下列说法正确的是( )
| A. | HCO3-的水解程度大于电离程度 | B. | HCO3-的水解程度小于电离程度 | ||
| C. | HCO3-的水解程度等于电离程度 | D. | 不能确定 |