题目内容
4.下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是( )| A. | CO2和SiO2 | B. | C60和Ar | C. | NaCl和HCl | D. | CaO和CsCl |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答 解:A、固体CO2是分子晶体,二氧化硅是原子晶体,二氧化硅、二氧化碳都只含共价键,故A错误;
B、固体C60和Ar都是分子晶体,Ar只含共价键,而稀有气体晶体中不存在化学键,故B错误;
C、NaCl是离子晶体,NaCl中只含离子键,固体HCl分子晶体,HCl中只含共价键,故C错误;
D、CaO和CsCl都是离子晶体,只含离子键,故D正确;
故选:D.
点评 本题考查化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以范德华力结合,分子内部存在化学键.

练习册系列答案
相关题目
14.钾和钠的化学性质相似,下列说法中能最好的解释这个事实的是( )
| A. | 都是金属元素 | B. | 原子半径相差不大 | ||
| C. | 原子的最外层电子数相同 | D. | 最高化合价相同 |
15.汽车尾气中NO产生的反应为N2(g)+O2(g)?2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是( )

| A. | 温度T下,该反应的平衡常数K=$\frac{({c}_{0}-{c}_{1})^{2}}{{{c}_{1}}^{2}}$ | |
| B. | 若曲线b对应的条件改变是温度,可判断该反应的△H<0 | |
| C. | 曲线b对应的条件改变可能是加入了催化剂 | |
| D. | 温度T下,随着反应的进行,混合气体的密度不变 |
12.下列说法正确的是( )
| A. | 工业上生产水泥和玻璃都要用石灰石做原料 | |
| B. | 玻璃钢是一种合金材料 | |
| C. | 除去氨气中的水蒸气可用无水氯化钙可做干燥剂 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
19.下列说法正确的是( )
| A. | 离子化合物NH4Cl中既存在离子键,又存在极性共价键 | |
| B. | H2S的电子式是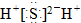 | |
| C. | 化学键包括离子键、共价键、氢键等 | |
| D. | LiOH、NaOH、KOH的碱性逐渐减弱 |
9.下列方法中不能用来区别NaNO2和NaCl的是( )
| A. | 测定这两种溶液的pH值 | B. | 在酸性条件下加入KI淀粉溶液 | ||
| C. | 观察二者的颜色 | D. | 用AgNO3和HNO3两种试剂来区别 |
16.下列实验操作或实验所得出的结论正确的是( )
| A. | 镀锌层破损后即对镀锌铁(白铁)制品失去保护作用 | |
| B. | 用托盘天平称取5.85gNaCl,称量时砝码放在右盘,氯化钠放在左盘 | |
| C. | 在制备硝酸钾晶体实验中先常温减压过滤,后高温常压过滤 | |
| D. | 食醋用氢氧化钠溶液滴定开始时,溶液的pH通常变化缓慢,当接近完全反应时(即滴定终点),pH出现突变,称为滴定突跃 |
13.下列关于影响化学反应速率的条件的说法正确的是( )
| A. | 增大压强一定能加快化学反应速率 | |
| B. | 化学反应中,反应物所处的状态对反应速率没有影响 | |
| C. | 化学反应速率改变,化学平衡一定会发生移动 | |
| D. | 升高温度,一定能加快化学反应速率 |
14.2C+O2=2CO,2CO+O2=2CO2都是放热反应.下列说法不正确的是( )
| A. | 12gC与16gO2所具有的总能量一定高于28gCO所具有的能量 | |
| B. | 56gCO所具有的能量大于88gCO2所具有的总能量 | |
| C. | 12gC和32gO2所具有的总能量大于44gCO2所具有的总能量 | |
| D. | 将一定质量的碳燃烧,生成CO2比生成CO时放出的热量多 |