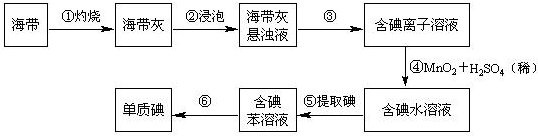
题目内容
已知室温时,0.1mol?L?1的某一元酸HA在水中有0.1%发生电离,回答下列各问题:
(1)该溶液c(H+)= ,pH=
(2)HA的电离平衡常数表达式K= ,数值约为
(3)升高温度时,K将 ,(填“增大”“减小”或“不变”,下同),pH将
(4)该溶液中c(OH-)= ,由水电离出来的c(H+)=
(5)将该溶液加水稀释,K将 (填“增大”“减小”或“不变”下同),n(H+)将 ,c(A-)将 ,
将 .
(1)该溶液c(H+)=
(2)HA的电离平衡常数表达式K=
(3)升高温度时,K将
(4)该溶液中c(OH-)=
(5)将该溶液加水稀释,K将
| c(H+) |
| c(HA) |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:(1)0.1mol/L的某一元酸HA在水中有0.1%发生电离,则溶液中c(H+)=0.1mol/L×0.1%=10-4mol/L,pH=-lgc(H+);
(2)电离平衡常数K=
,将溶液中各个数据代入即可;
(3)升高温度促进HA电离;
(4)该溶液中c(OH-)=
,酸性溶液中水电离出的c(H+)等于溶液中c(OH-);
(5)电离平衡常数只与温度有关,温度不变,电离平衡常数不变,所以K不变,稀释过程中促进HA电离,则n(H+)增大,n(HA)减小、c(A-)减小.
(2)电离平衡常数K=
| c(A-).c(H+) |
| c(HA) |
(3)升高温度促进HA电离;
(4)该溶液中c(OH-)=
| Kw |
| c(H+) |
(5)电离平衡常数只与温度有关,温度不变,电离平衡常数不变,所以K不变,稀释过程中促进HA电离,则n(H+)增大,n(HA)减小、c(A-)减小.
解答:
解:(1)0.1mol/L的某一元酸HA在水中有0.1%发生电离,则溶液中c(H+)=0.1mol/L×0.1%=10-4 mol/L,pH=-lgc(H+)=-lg10-4=4,
故答案为:10-4;4;
(2)电离平衡常数K=
,K=
=
=10-7,
故答案为:
;10-7;
(3)升高温度促进HA电离,K值增大,溶液中氢离子浓度增大,则溶液的pH减小,故答案为:增大;减小;
(4)该溶液中c(OH-)=
=
mol/L=10-10 mol/L,酸性溶液中水电离出的c(H+)等于溶液中c(OH-)为10-10 mol/L,
故答案为:10-10 mol/L;10-10 mol/L;
(5)电离平衡常数只与温度有关,温度不变,电离平衡常数不变,所以K不变,稀释过程中促进HA电离,则n(H+)增大,c(A-)减小、n(HA)减小,所以
将增大,故答案为:不变;增大;减小;增大.
故答案为:10-4;4;
(2)电离平衡常数K=
| c(A-).c(H+) |
| c(HA) |
| c(A-).c(H+) |
| c(HA) |
| 10-4×10-4 |
| 0.1 |
故答案为:
| c(A-).c(H+) |
| c(HA) |
(3)升高温度促进HA电离,K值增大,溶液中氢离子浓度增大,则溶液的pH减小,故答案为:增大;减小;
(4)该溶液中c(OH-)=
| Kw |
| c(H+) |
| 10-14 |
| 10-4 |
故答案为:10-10 mol/L;10-10 mol/L;
(5)电离平衡常数只与温度有关,温度不变,电离平衡常数不变,所以K不变,稀释过程中促进HA电离,则n(H+)增大,c(A-)减小、n(HA)减小,所以
| c(H+) |
| c(HA) |
点评:本题考查了弱电解质的电离,加水稀释促进弱电解质电离,溶液中部分粒子浓度减小,部分离子浓度增大,再结合离子积常数分析解答,注意酸溶液中水电离出氢离子浓度的计算方法,为易错点.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
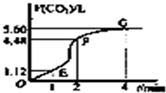 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题: