题目内容
(1)已知:BaSO4(s)+4C(s)=4CO(g)+BaS(s);△H1=571.2kJ/mol,
BaSO4(s)+2C(s)=2CO2(g)+BaS(s);△H2=226.2kJ/mol.
则反应C(s)+CO2(g)=2CO(g)的△H3= kJ/mol
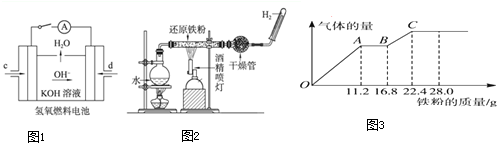
(2)如图所示装置工作时均与H2有关.
①图1所示装置中,通入H2的管口的电极反应式为 .
②某同学按图2所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论 (填“严密”或“不严密”),你的理由是 (用离子方程式和必要的文字说明).
(3)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,60mol CuSO4能氧化白磷的物质的量是 .
(4)某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图3示.则BC段气体是产生的气体是 ;OA段离子反应方程式为 ,c(H2SO4)为 .
BaSO4(s)+2C(s)=2CO2(g)+BaS(s);△H2=226.2kJ/mol.
则反应C(s)+CO2(g)=2CO(g)的△H3=
(2)如图所示装置工作时均与H2有关.
①图1所示装置中,通入H2的管口的电极反应式为
②某同学按图2所示装置进行实验,实验结束后,将玻璃管内固体物质冷却后,溶于稀硫酸,充分反应后,滴加KSCN溶液,溶液不变红,再滴入新制氯水,溶液变为红色.该同学据此得出结论:铁与水蒸气反应生成FeO和H2.该结论
(3)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4,60mol CuSO4能氧化白磷的物质的量是
(4)某稀硫酸和稀硝酸的混合溶液200mL,向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图3示.则BC段气体是产生的气体是

考点:氧化还原反应的计算,用盖斯定律进行有关反应热的计算,化学电源新型电池,铁及其化合物的性质实验
专题:电化学专题,几种重要的金属及其化合物
分析:(1)利用盖斯定律计算反应热;
(2)①该装置是原电池,根据氢氧根离子移动方向知,右边电极为负极、左边电极为正极,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子发生还原反应生成氢氧根离子;
②即使有生成的四氧化三铁,溶于稀硫酸后Fe3+可与过量的Fe反应生成Fe2+;
(3)该反应11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4中P元素化合价由0变为-3价和+5价,Cu元素化合价由+2价变为+1价,该反应中被氧化的白磷占参加反应白磷的
,根据转移电子计算被硫酸铜氧化的白磷;
(4)Fe先和稀硝酸反应生成硝酸铁、NO和水,然后Fe再和铁离子反应生成亚铁离子,最后铁和稀硫酸反应生成硫酸亚铁和氢气,稀硫酸和稀硝酸都提供氢离子,所以硝酸根离子完全反应生成NO,则最后得到溶液中的溶质为硫酸亚铁,根据铁原子守恒计算.
(2)①该装置是原电池,根据氢氧根离子移动方向知,右边电极为负极、左边电极为正极,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子发生还原反应生成氢氧根离子;
②即使有生成的四氧化三铁,溶于稀硫酸后Fe3+可与过量的Fe反应生成Fe2+;
(3)该反应11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4中P元素化合价由0变为-3价和+5价,Cu元素化合价由+2价变为+1价,该反应中被氧化的白磷占参加反应白磷的
| 6 |
| 11 |
(4)Fe先和稀硝酸反应生成硝酸铁、NO和水,然后Fe再和铁离子反应生成亚铁离子,最后铁和稀硫酸反应生成硫酸亚铁和氢气,稀硫酸和稀硝酸都提供氢离子,所以硝酸根离子完全反应生成NO,则最后得到溶液中的溶质为硫酸亚铁,根据铁原子守恒计算.
解答:
解:(1)BaSO4(s)+4C(s)=4CO(g)+BaS(s)△H1=571.2kJ/mol①,
BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=226.2kJ/mol ②
将方程式
得C(s)+CO2(g)=2CO(g),则△H3=
=172.5kJ/mol
故答案为:172.5;
(2)①该装置是原电池,根据氢氧根离子移动方向知,右边电极为负极、左边电极为正极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2e-+2OH-=2H20,故答案为:H2+2e-+2OH-=2H20;
②即使有生成的四氧化三铁,溶于稀硫酸后Fe3+可与过量的Fe反应生成Fe2+,所以向溶液中滴加KSCN溶液时,混合溶液不变红色,所以该实验不严密,离子反应方程式为2Fe3++Fe═3Fe2+,
故答案为:不严密;产物中含+3价铁的物质与稀硫酸反应后生成Fe3+,Fe3+可与过量的Fe反应生成Fe2+,2Fe3++Fe═3Fe2+;
(3)该反应11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4中P元素化合价由0变为-3价和+5价,Cu元素化合价由+2价变为+1价,该反应中被氧化的白磷占参加反应白磷的
,假设有60mol硫酸铜参加反应,则有11mol白磷参加反应,其中被氧化的白磷物质的量=11mol×
=6mol,根据转移电子守恒知,60mol硫酸铜完全反应得到60mol电子,则被硫酸铜氧化的白磷物质的量=
=3mol,
故答案为:3mol;
(4)Fe先和稀硝酸反应生成硝酸铁、NO和水,然后Fe再和铁离子反应生成亚铁离子,最后铁和稀硫酸反应生成硫酸亚铁和氢气;所以BC段产生的气体是氢气,OA段是铁和稀硝酸的反应,离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,
稀硫酸和稀硝酸都提供氢离子,所以硝酸根离子完全反应生成NO,则最后得到溶液中的溶质为硫酸亚铁,最终溶解Fe的质量为22.4g,则n(Fe)=
=0.4mol,
根据n(Fe)=n(H2SO4)=n(FeSO4)=0.4mol,则c(H2SO4)=
=2mol/L,
故答案为:H2;Fe+4H++NO3-═Fe3++NO↑+2H2O;2 mol?L-1 .
BaSO4(s)+2C(s)=2CO2(g)+BaS(s)△H2=226.2kJ/mol ②
将方程式
| ①-② |
| 2 |
| 571.2kJ/mol-226.2kJ/mol |
| 2 |
故答案为:172.5;
(2)①该装置是原电池,根据氢氧根离子移动方向知,右边电极为负极、左边电极为正极,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2+2e-+2OH-=2H20,故答案为:H2+2e-+2OH-=2H20;
②即使有生成的四氧化三铁,溶于稀硫酸后Fe3+可与过量的Fe反应生成Fe2+,所以向溶液中滴加KSCN溶液时,混合溶液不变红色,所以该实验不严密,离子反应方程式为2Fe3++Fe═3Fe2+,
故答案为:不严密;产物中含+3价铁的物质与稀硫酸反应后生成Fe3+,Fe3+可与过量的Fe反应生成Fe2+,2Fe3++Fe═3Fe2+;
(3)该反应11P4+60CuSO4+96H2O═20Cu3P+24H3PO4+60H2SO4中P元素化合价由0变为-3价和+5价,Cu元素化合价由+2价变为+1价,该反应中被氧化的白磷占参加反应白磷的
| 6 |
| 11 |
| 6 |
| 11 |
| 60mol |
| (5×4) |
故答案为:3mol;
(4)Fe先和稀硝酸反应生成硝酸铁、NO和水,然后Fe再和铁离子反应生成亚铁离子,最后铁和稀硫酸反应生成硫酸亚铁和氢气;所以BC段产生的气体是氢气,OA段是铁和稀硝酸的反应,离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,
稀硫酸和稀硝酸都提供氢离子,所以硝酸根离子完全反应生成NO,则最后得到溶液中的溶质为硫酸亚铁,最终溶解Fe的质量为22.4g,则n(Fe)=
| 22.4g |
| 56g/mol |
根据n(Fe)=n(H2SO4)=n(FeSO4)=0.4mol,则c(H2SO4)=
| 0.4mol |
| 0.2L |
故答案为:H2;Fe+4H++NO3-═Fe3++NO↑+2H2O;2 mol?L-1 .
点评:本题考查较综合,涉及盖斯定律、氧化还原反应的计算、混合物反应的计算、原电池原理等知识点,侧重考查学生分析、计算能力,注意(3)中计算的是被硫酸铜氧化的白磷,明确(4)溶液中的溶质即可解答此题,这些都是易错点,题目难度中等.

练习册系列答案
相关题目
锌锰干电池是生活中应用最广泛的电池,下列说法中不正确的是( )
| A、该电池正极反应式为:MnO2+H2O+e-=MnOOH+OH- |
| B、电池工作时负极pH一定降低 |
| C、用该电池作电源精炼铜,纯铜与锌连接 |
| D、用该电池作电源电解硫酸铜溶液,负极溶解6.5g锌,阴极一定析出6.4g铜 |
下列反应的离子方程式书写错误的是( )
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
下列叙述正确的是( )
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
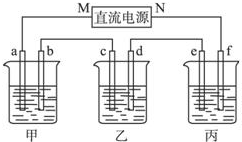 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: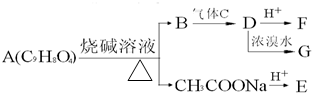 A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
A为药用有机物,从A出发可发生如图所示的一系列反应.已知A在一定条件下能与醇发生酯化反应,A分子中的苯环上有两个取代基,且苯环上的一卤代物有两种,D不能与NaHCO3溶液反应,但能与NaOH溶液反应.请回答下列问题:
