题目内容
15. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表(表中不要留空格).
| 验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
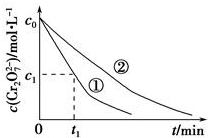
(3)实验①和②的结果表明溶液pH对该反应的速率有影响;实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三.
假设一:Fe2+起催化作用:
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;…
(5)请你设计实验验证上述假设一,完成下表中内容.
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
分析 (1)①②中PH不同,是探究PH对速率的影响;则②③是探究不同浓度时草酸对速率的影响;
(2)草酸中碳元素化合价为+3价,被氧化为+4价,Cr2O72-转化为Cr3+,根据电子守恒来计算;
(3)实验①②表明溶液pH越小,反应的速率越快,根据公式求算;
(4)根据铁明矾的组成分析;
(5)做对比实验:要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验.
解答 解:(1)①②中PH不同,是探究PH对速率的影响;则②③是探究不同浓度时草酸对速率的影响,故答案为:20;
(2)草酸中碳元素化合价为+3价,氧化产物为CO2,被氧化为+4价,化合价共升高2价,Cr2O72-转化为Cr3+,化合价共降低了6价,根据电子守恒,参加反应的Cr2O72-与草酸的物质的量之比为是1:3,故答案为:1:3;
(3)由实验①②表明溶液pH越小,反应的速率越快,所以溶液pH对该反应的速率有影响,v(Cr3+)=2v(Cr2O72-)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1,
故答案为:溶液pH对该反应的速率有影响;$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$;
(4)根据铁明矾[Al2Fe(SO4)4•24H2O]组成分析,Al3+起催化作用;SO42-起催化作用,故答案为:Al3+起催化作用;SO42-起催化作用;
(5)要证明Fe2+起催化作用,需做对比实验,再做没有Fe2+存在时的实验,所以要选K2SO4•Al2(SO4)3•24H2O,注意由于需要控制Al3+和SO42-浓度比,不要选用K2SO4和Al2(SO4)3;用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验,反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立;故答案为:
| 实验方案 | 预期实验结果和结论 |
| 用等物质的量K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后,若溶液中c(Cr2O72-)大于实验①中c(Cr2O72-),则假设一成立;若两溶液中的c(Cr2O72-)相同,则假设一不成立 |
点评 本题考查了探究重铬酸根与草酸反应过程中的催化作用,该反应为一比较熟悉的反应,还考查了从图象中获取数据并分析的能力、设计实验的能力等.

| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
| A. | 必然引起物质状态的变化 | B. | 会产生新的物质 | ||
| C. | 必然会引起化学键的变化 | D. | 必然伴随着能量的变化 |
| A. | Mg | B. | Al | C. | Si | D. | S |
| A. | 熔点:GeCl4<NaCl | |
| B. | 酸性:Ge(OH)4>Sn(OH)4>Pb(OH)4 | |
| C. | 相同条件下,锗、锡、铅单质分别与稀硫酸反应,速率依次减慢 | |
| D. | 常温下在空气中,锗单质不被氧化,铅单质表面生成一层保护薄膜 |
| A. | 石油主要是各种烷烃、环烷烃组成的混合物 | |
| B. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| C. | 蔗糖和麦芽糖二者互为同分异构体,且都是还原性糖 | |
| D. | 苯、油脂均能使酸性KMnO4溶液褪色 |
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 丁二烯 |
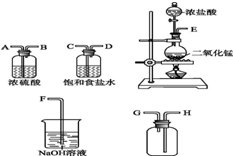 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
 (写结构简式).
(写结构简式).