题目内容
20.下列实验能达到实验目的且符合安全要求的是( )| A. |  利用排空气法收集CO2 | B. |  收集氧气 | ||
| C. |  制备并检验氢气的可燃性 | D. |  氨水溶于水 |
分析 A.二氧化碳的密度比空气密度大;
B.氧气不溶于水;
C.氢气具有可燃性,不纯点燃可发生爆炸;
D.氨气极易溶于水.
解答 解:A.二氧化碳的密度比空气密度大,应从长导管进气,利用向上排空气法收集,故A错误;
B.氧气不溶于水,图中排水法收集合理,故B正确;
C.氢气具有可燃性,不纯点燃可发生爆炸,不能立即点燃,操作不合理,故C错误;
D.氨气极易溶于水,图中易发生倒吸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,侧重于学生的分析能力、实验能力的考查,把握物质的性质、实验技能、实验装置的作用为解答的关键,题目难度不大.

练习册系列答案
相关题目
15.已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ•mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ•mol-1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
| A. | Fe3O4+4CO=3Fe+4CO2△H=-14kJ•mol-1 | |
| B. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-22kJ•mol-1 | |
| C. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=+14kJ•mol-1 | |
| D. | Fe3O4(s)+4CO(g)=3Fe(s)+4CO2(g)△H=-14kJ•mol-1 |
5.结合元素周期表和周期律的相关知识,判断下列说法正确的是( )
| A. | 短周期主族元素原子的最外层电子数都等于元素的最高化合价 | |
| B. | 多电子原子中,在离核较近的区域内运动的电子能量较高 | |
| C. | 同周期第ⅡA族与第ⅢA族的元素原子序数之差不一定为1 | |
| D. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
12.表是元素周期表的一部分,回答下列有关问题:
(1)写出下列元素符号:④Mg;⑫Br.
(2)画出原子的结构示意图:⑤ ;⑪
;⑪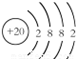 .
.
(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
(7)元素①是动植物生长不可缺少的元素,是蛋白质的重要成分.其氢化物常用作制冷剂,该氢化物的电子式为: ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
| 周期 期 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)画出原子的结构示意图:⑤
 ;⑪
;⑪ .
.(3)在①~⑫元素中,金属性最强的元素是K,非金属性最强的元素是F,最不活泼的元素是Ar.(均填元素符号)
(4)元素⑦与元素⑧相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b.
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(5)第三周期中原子半径最大的元素跟它同周期中原子半径最小的元素(稀有气体除外)可以形成离子(填离子或共价)化合物.
(6)元素⑥是构成地壳的主要元素之一,其氧化物是现代光学及光纤制品的基本原料,该氧化物的化学式为SiO2该氧化物中含有的化学键是共价键(填“离子”或“共价”)
(7)元素①是动植物生长不可缺少的元素,是蛋白质的重要成分.其氢化物常用作制冷剂,该氢化物的电子式为:
 ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L.min).
9.对于反应CO(g)+H2O(g)?H2(g)+CO2(g)正反应是放热反应,在其他条件不变的情况下,下列说法正确的是( )
| A. | 加入催化剂,改变了反应的途径,反应放出的热量也一定发生变化 | |
| B. | 改变压强,平衡不发生移动,反应放出的热量不变 | |
| C. | 升高温度,反应速率加快,反应放出的热量不变 | |
| D. | 若在原电池中进行,反应放出的热量不变 |
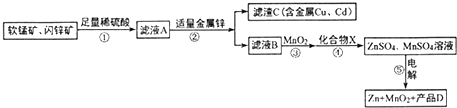
 或
或 .
. .
. 在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图:
在实验室中用二氧化锰与浓盐酸反应制备干燥纯净的氯气.进行此实验,所用仪器如图: