题目内容
16.NaCl是一种化工原料,可以制一系列物质(如图).下列说法正确的是( )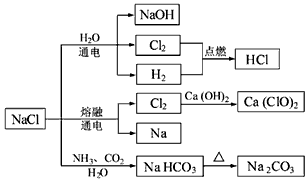
| A. | 石灰乳与Cl2的反应中,Cl2既作氧化剂,又作还原剂 | |
| B. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| C. | 图示的转化反应中有3个分解反应 | |
| D. | 图示的转化反应都是氧化还原反应 |
分析 A.根据化合价的变化判断;
B.NaHCO3在水中的溶解度比Na2CO3的小;
C.电解熔融NaCl是分解反应,NaHCO3分解生成Na2CO3是分解反应;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应不是氧化还原反应.
解答 解:A.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,只有Cl元素的化合价发生变化,Cl2既是氧化剂,又是还原剂,故A正确;
B.NaHCO3在水中的溶解度比Na2CO3的小,如在饱和碳酸钠溶液中通入二氧化碳会生成碳酸氢钠沉淀,故B错误;
C.图示中只有电解熔融NaCl以及NaHCO3分解生成Na2CO3是分解反应,故C错误;
D.NaCl生成NaHCO3,以及NaHCO3分解生成Na2CO3的反应,各元素化合价不变,不是氧化还原反应,故D错误;
故选A.
点评 本题以氯化钠的性质和用途为载体,综合考查氯碱工业、侯氏制碱法、元素及其化合物的性质、氧化还原反应等知识,侧重于学生的分析能力和基本概念的考查,题目难度不大.

练习册系列答案
相关题目
8.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 向某无色溶液中滴加氯水后,再滴加淀粉溶液 | 溶液变为蓝色 | 原溶液为KI溶液 |
| B | 向10mL浓度均为0.1mol/L的MgCl2和CuCl2的混合溶液中滴加一滴0.1mol/L的NaOH溶液 | 出现蓝色沉淀 | Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 向某未知溶液中滴加稀盐酸后产生无色气体,气体通入品红溶液中 | 品红溶液褪色 | 原溶液中有SO32- |
| D | 用刚洗净未干燥的容量瓶配制0.1mol/L的NaOH溶液 | 所配制的溶液浓度偏小 |
| A. | A | B. | B | C. | C | D. | D |
7.某些建筑材料含有放射性元素氡(22286Rn).研究表明氡的α射线会致癌,WHO认定的19种致癌因素中,氡为其中之一,仅次于吸烟.该原子中中子数和质子数之差是( )
| A. | 136 | B. | 50 | C. | 86 | D. | 222 |
11.肼(N2H4)是一种燃料,已知:
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
③H2O(g)=H2O(l )△H=-44kJ/mol
下列说法正确的是( )
①N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534kJ/mol
③H2O(g)=H2O(l )△H=-44kJ/mol
下列说法正确的是( )
| A. | 反应②中反应物所具有的总能量大于生成物所具有的总能量 | |
| B. | 2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l)△H=-1135.7 kJ/mol | |
| C. | 铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,当电路中转移0.16mole-,生成N211.2g | |
| D. | 铂作电极,Na2SO4作电解质溶液,由反应②设计的燃料电池,工作一段时间后恢复至原温度,Na2SO4溶液的pH不变 |
5.下列变化中,需加入还原剂才能实现的是( )
| A. | HCO3-→CO32- | B. | MnO2→Mn2+ | C. | FeO→Fe3O4 | D. | Cl-→Cl2 |
6.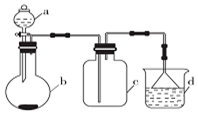 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
 实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )| 选项 | a中物质 | b中物质 | c中物质 | d中收集的气体 |
| A | 浓氨水 | CaO | NH3 | H3O |
| B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
| C | 浓硝酸 | Cu | NO2 | H2O |
| D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |