题目内容
7.下列反应中,属于氧化还原反应的是( )| A. | 2 Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$ Al2O3+3 H2O | B. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ | ||
| C. | FeO+2 HCl═FeCl2+H2O | D. | FeCl2+2NaOH═Fe (OH)2↓+2NaCl |
分析 属于氧化还原反应,说明该反应中有电子转移,其特征是有元素化合价升降,据此分析解答.
解答 解:A.氢氧化铝的分解中各元素化合价不变,所以不属于氧化还原反应,属于分解反应,故A错误;
B.2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑中氧元素化合价变化,则有电子转移,属于氧化还原反应,故B正确;
C.FeO+2 HCl═FeCl2+H2O中各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,故C错误;
D.FeCl2+2NaOH═Fe (OH)2↓+2NaCl中各元素化合价不变,所以不属于氧化还原反应,属于复分解反应,故D错误;
故选B.
点评 本题考查了氧化还原反应判断,根据元素化合价变化来分析解答即可,知道常见元素化合价及常见反应类型,题目难度不大.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
18.贮存粮食、水果的仓库内可用的保护气是( )
| A. | O2 | B. | N2 | C. | CO2 | D. | H2 |
15.下列各物质间的反应,生成的盐不止一种的是( )
| A. | 氧化铁与稀盐酸 | B. | 铜与浓硫酸 | ||
| C. | 钠在氯气中燃烧 | D. | 氯气通入烧碱溶液 |
2.某科学探究小组为探究电化学原理,设计了如图所示的装置进行探究实验.下列对实验中观察到的现象或有关结论错误的是( )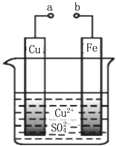

| A. | a和b不连接时,铁片上有红色的铜析出,该装置不能形成原电池 | |
| B. | a和b用导线连接时铜片为负极,发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会被氧化,溶液中均有Fe2+生成 | |
| D. | a和b用导线连接时,溶液中的Cu2+应向铜电极移动 |
12.已知:C (s)+0.5O2(g)═CO(g) H=-110.50KJ/mol
C(s)+O2(g)═CO2(g) H=-393.51KJ/mol
则反应C (s)+CO2(g)═2CO(g)的△H为( )
C(s)+O2(g)═CO2(g) H=-393.51KJ/mol
则反应C (s)+CO2(g)═2CO(g)的△H为( )
| A. | -283.01KJ/mol | B. | +172.51 KJ/mol | C. | +283.01KJ/mol | D. | -504.01 KJ/mol |
20.表是元素周期表的一部分.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
(1)写出下列元素符号:①N,⑥Si.
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程: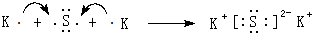 .
.
(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
根据①~⑫元素在周期表中的位置,回答下列有关问题:(请用化学符号填写)
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
(2)在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3.(用化学式填写)
(3)在这些元素中单质的氧化性最强的是F2,还原性最强的是K.化学性质最不活泼的元素是Ar.(用化学式填写)
(4)用电子式表示⑦和⑩形成化合物的过程:
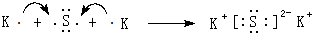 .
.(5)⑦和⑧分别形成的气态氢化物中相对不稳定的是H2S.
 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二.
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二. 无色,无气味并且易燃.是常见的一种化石能源.
无色,无气味并且易燃.是常见的一种化石能源. 有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.
有强氧化性的弱酸,见光易分解,具有漂白性,可以用于消毒杀菌.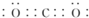 .
.