题目内容
2.工业上制备单质碘的方法之一是从碘酸盐开始的.第一步先用适量的亚硫酸氢盐将碘酸盐还原成碘化物,离子方程式为:IO${\;}_{3}^{-}$+3HSO${\;}_{3}^{-}$?I-+3SO${\;}_{4}^{2-}$+3H+.第二步将第一步得到的酸性碘化物溶液再跟适量的碘酸盐溶液合,发生反应析出了碘.请回答下列各小题:(1)第二步发生反应的离子方程式是5 I-+IO3-+6H+=3I2 +3H2O.
(2)若要使碘酸盐的利用率最高,碘酸盐的第二步和第一步反应中的用量之比为5:1.
(3)①配平下列离子方程式:
2Fe(OH)3+(5-n)ClO-+2nOH-→2FeO4n-+(5-n )Cl-+(n+3)H2O
②已知有3.21gFe(OH)3参加了反应,共转移了5.418×1022个电子,则n=2.
③根据(1)、(2)推测FeO4n-能和下列BC(填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2.
分析 (1)酸性碘化物溶液再跟适量的碘酸盐溶液合,发生反应析出了碘,为氧化还原反应,遵循电子、电荷守恒;
(2)结合两个反应判断碘酸盐的用量;
(3)①Fe元素的化合价升高,Cl元素的化合价降低,遵循电子、电荷守恒;
②结合反应及元素的化合价计算n;
③与具有还原性的物质发生反应.
解答 解:(1)由题意知,反应物有氢离子、碘离子、碘酸根离子,生成物有碘单质,再根据原子守恒判断生成物还有水,再由电子守恒可知离子反应为5 I-+IO3-+6H+=3I2 +3H2O,
故答案为:5 I-+IO3-+6H+=3I2 +3H2O;
(2)由IO3-+3HSO3-?I-+3SO42-+3H+、5 I-+IO3-+6H+=3I2 +3H2O可知,若要使碘酸盐的利用率最高,均恰好完全反应,则碘酸盐的第二步和第一步反应中的用量之比为5:1,
故答案为:5:1;
(3)①元素的化合价变化分别是:Fe元素由Fe(OH)3中+3价变成-FeO4n中+(8-n)价,失去电子数为(5-n)个;Cl元素由ClO-中的+1价变成Cl-中的-1价,得电子数为2个;根据氧化还原反应中得失电子守恒,其最小公倍数为2(5-n),则离子反应为2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n )Cl-+(n+3)H2O,
故答案为:2; (5-n); 2n;2;(5-n );(n+3)
②Fe(OH)3的物质的量为$\frac{3.21g}{107g/mol}$=0.03mol,转移电子为$\frac{5.415×1{0}^{22}}{6.02×1{0}^{23}}$=0.09mol,
2 Fe(OH)3 +(5-n)ClO-+2n OH-=2 FeO4n-+(5-n) Cl-+(3+n) H2O 转移电子数
2 2(5-n)
0.03mol 0.09mol
所以n=2,
故答案为:2;
③FeO4n-中Fe的化合价为+6价,为高价态,具有强氧化性,能和强还原性的物质反应,与具有还原性的SO2和H2S反应,故选BC.
点评 本题考查离子方程式的书写及氧化还原反应,为高频考点,把握发生的反应及反应中元素化合价变化为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案| A. | 原子半径:A<C<B | |
| B. | 2.32g四氧化三铁与足量的B完全反应转移0.09mol电子 | |
| C. | C的气态氢化物无毒 | |
| D. | A元素在周期表中位于第二周期第VIA族 |

| A. | SO2 | B. | NH3 | C. | CO2 | D. | Cl2 |
| A. | 长颈漏斗 | B. | 分液漏斗 | C. | 圆底烧瓶 | D. | 蒸馏烧瓶 |
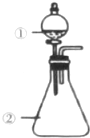 用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中.预测的现象与结论相符的是( )| 选项 | ① | ② | 预测②中现象 | 实验结论 |
| A | 浓硫酸 | 浓盐酸 | 产生大量气体 | 硫酸的酸性比盐酸强 |
| B | 浓硫酸 | 铜片 | 铜片溶解,产生气泡,底部产生灰白色粉末 | 浓硫酸的酸性和强氧化性 |
| C | 浓硫酸 | CuSO4•5H2O | 固体由蓝色变为白色 | 浓硫酸具有吸水性,发生物理变化 |
| D | 浓硫酸 | 蔗糖 | 固体由白色变为黑色海绵状,并有刺激性气体放出 | 浓硫酸具有脱水性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到干燥的有色布条上 | ||
| ③ | 将足量的氯水滴加到Na2CO3溶液中 | 氯水中 含有H+ |
(2)指出实验②和实验③中的“实验现象”:
②有色布条褪色;③有气泡生成
(3)实验②的“实验现象”,同学们得出两个不同的结论.这两个结论可能是
a.Cl2具有漂白性,b.HClO具有漂白性.
请设计简单的实验证明哪一个是正确的用干燥的Cl2通入盛有干燥布条的瓶中观察是否褪色,若褪色证明a正确;若不褪色,证明b正确.
(4)若实验中使用的是久置的氯水,实验方法不变,对上述①③实验无影响.



