题目内容
10.一定条件下,Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-平衡.下列说法不正确的是( )| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
分析 A.$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$为碳酸根离子的水解平衡常数;
B.加入氢氧化钠后,氢氧根离子浓度增大,平衡向着逆向移动;
C.盐的水解反应为吸热反应,升高温度平衡向着正向移动;
D.通入二氧化碳后,氢氧根离子浓度减小,平衡向着正向移动.
解答 解:A.碳酸根离子的水解平衡常数Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$,温度不变,则该比值不变,故A错误;
B.加入NaOH固体,溶液中氢氧根离子浓度增大,则水解平衡向着逆向移动,碳酸氢根离子浓度减小,碳酸根离子浓度增大,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$的比值减小,故B正确;
C.升高温度,碳酸根离子的水解平衡向着逆向移动,则碳酸氢根离子、氢氧根离子浓度增大,碳酸根离子浓度减小,所以平衡常数Kh=$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大,故C正确;
D.二氧化碳与氢氧根离子反应,导致溶液中氢氧根离子浓度减小,溶液的pH减小,故D正确;
故选A.
点评 本题考查了盐的水解原理及其影响,题目难度中等,明确盐的水解原理为解答关键,注意盐的水解为吸热反应,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
18.中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等.因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据计算PM2.5待测试样的pH=4.
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
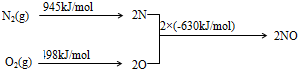
①N2(g)+O2(g)?2NO(g)△H=+183 kJ•moL-1.
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ 2CO2+N2.
③汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现?不能.你的依据是该反应是熵减、焓增的反应,任何温度下均不能自发进行.
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
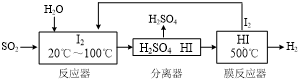
①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M?充电放电NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为4O2+4e-+2H2O=4OH-.
(1)将PM2.5样本用蒸馏水处理制成待测试样.若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3-[] | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5[] | 3×10-5 | 2×10-5 |
(2)NOx是汽车尾气的主要污染物之一.汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:

①N2(g)+O2(g)?2NO(g)△H=+183 kJ•moL-1.
②当尾气中空气不足时,NOx在催化转化器中被还原成N2排出.写出NO被CO还原的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$ 2CO2+N2.
③汽车汽油不完全燃烧时还产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g),已知该反应的△H>0,该设想能否实现?不能.你的依据是该反应是熵减、焓增的反应,任何温度下均不能自发进行.
(3)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+.
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行.
③用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池.电池充放电时的总反应为:Ni(OH)2+M?充电放电NiO(OH)+MH,电池放电时,负极电极反应式为MH+OH--e-=H2O+M; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为4O2+4e-+2H2O=4OH-.
15.下列物质性质与应用关系不正确的是( )
| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
2.下列原子中未成对电子(单独占据1个原子轨道的电子)数为2的是( )
| A. | O | B. | N | C. | Cu | D. | F |
19.下列说法正确的是( )
| A. | 可用丁达尔现象区分溶液与胶体 | |
| B. | 化学变化能够实现一种原子变为另一种原子 | |
| C. | O3是由3个氧原子构成的化合物 | |
| D. | CuSO4•5H2O是一种混合物 |
20.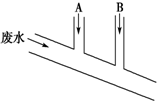 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
 人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.
人们对苯及芳香烃的认识有一个不断深化的过程,回答下列问题.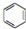 (Ⅱ)
(Ⅱ)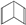
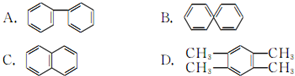
 .
.