题目内容
15.下列物质性质与应用关系不正确的是( )| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
分析 A.SO2具有漂白性,可与品红化合生成无色的物质,二氧化硫属于酸性氧化物和碱溶液发生反应;
B.Na2O2与水和二氧化碳反应都会生成氧气;
C.熔点高的物质做耐火材料;
D.常温下,铝遇到浓硝酸会钝化;
解答 解:A.滴有酚酞的NaOH溶液中通入SO2气体后溶液褪色,发生复分解反应生成亚硫酸钠和水,体现酸性氧化物的性质,故A不正确;
B.Na2O2与水和二氧化碳反应都会生成氧气,所以过氧化钠可以用作供氧剂,故B正确;
C.MgO、Al2O3的熔点较高,所以能制作耐高温材料,故C正确.
D.常温下,铝遇到浓硝酸会钝化,可用铝罐车贮运浓硝酸,故D正确.
故选A.
点评 本题考查了化学知识在日常生活中的应用,难度不大,注意知识的积累,掌握基础是解题关键.

练习册系列答案
 出彩同步大试卷系列答案
出彩同步大试卷系列答案
相关题目
9.下列说法或表示方法正确的是( )
| A. | 乙烯的结构简式CH2CH2 | B. | 甲基的电子式: | ||
| C. |  官能团为-CHO 所以该物质是醛 官能团为-CHO 所以该物质是醛 | D. | 聚乙烯的化学式为 |
6.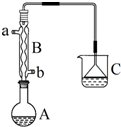 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
NaBr+H2SO4═HBr+NaHSO4
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
实验步骤:在装置A中加入2mL水,并小心加入28mL浓硫酸,混合均匀后冷却至室温.再依次加入18.5mL正丁醇和26g溴化钠,充分摇振后加入沸石,连接气体吸收装置C.将装置A置于石棉网上加热至沸腾,然后调节为小火使反应物保持平稳地回流.一段时间后停止加热,待反应液冷却后,拆去装置B,改为蒸馏装置,蒸出粗正溴丁烷.
请回答下列问题:
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流;操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,装置C中倒立的漏斗作用是防止倒吸.
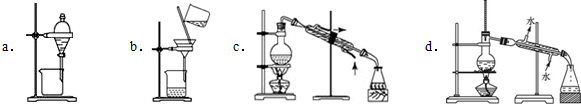
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的d制备纯净的正溴丁烷.
(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.7g纯净的正溴丁烷,则该实验的产率是50%.
 正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:
正溴丁烷(CH3CH2CH2CH2Br)是一种重要的有机合成工业原料.在实验中可利用下图装置(加热或夹持装置省略)制备正溴丁烷.制备时的化学反应方程式及有关数据如下:NaBr+H2SO4═HBr+NaHSO4
C4H9OH+HBr$\stackrel{浓硫酸}{→}$C4H9Br+H2O
| 物质 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 水中溶解性 |
| 正丁醇 | 74 | 0.80 | 117.3 | 微溶 |
| 正溴丁烷 | 137 | 1.27 | 101.6 | 难溶 |
| 溴化氢 | 81 | --- | --- | 极易溶解 |
请回答下列问题:
(1)仪器A的名称是圆底烧瓶,仪器B的作用是冷却、回流;操作中加入沸石的作用是防止暴沸.
(2)装置C中盛装的液体是NaOH溶液,装置C中倒立的漏斗作用是防止倒吸.
(3)制备的粗产物正溴丁烷中往往含有水分、正丁醇等杂质,加入干燥剂出去水分后,再由下列操作中的d制备纯净的正溴丁烷.

(4)若制备实验的“回流”过程中不采用“调节为小火”,仍采用大火加热回流,则会使产品产率偏低(填“高”或“低”),试说出其中一种原因:大火,副反应多或产物逸出较多.
(5)若最终得到13.7g纯净的正溴丁烷,则该实验的产率是50%.
10.一定条件下,Na2CO3溶液中存在CO32-+H2O?HCO3-+OH-平衡.下列说法不正确的是( )
| A. | 稀释溶液,$\frac{c(HC{{O}_{3}}^{-})•c(O{H}^{-})}{c(C{{O}_{3}}^{2-})}$增大 | |
| B. | 加入NaOH固体,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$减小 | |
| C. | 升高温度,平衡常数增大 | |
| D. | 通入CO2,溶液pH减小 |
7.NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数为0.2NA | |
| D. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
4.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下,1molC2H4所含的电子数为12 NA | |
| B. | 标准状况下,16g甲烷中共价键数目为4NA | |
| C. | 常温常压,4 g氦气所含的核外电子数为4NA | |
| D. | 标准状况下,22.4L NO 与11.2L O2 充分反应后,所得的气体分子数一定为NA |
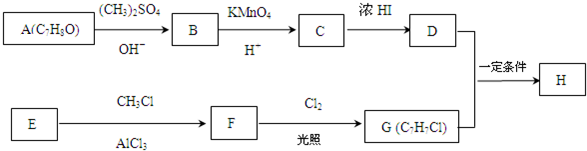
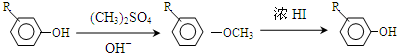
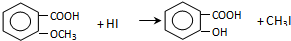 .
. +Cl2$\stackrel{光照}{→}$
+Cl2$\stackrel{光照}{→}$ +HCl,反应类型为取代反应.
+HCl,反应类型为取代反应.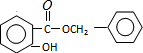 .
. (或
(或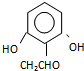 .
.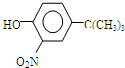
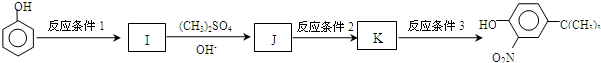
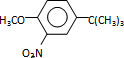 ,反应条件3所用的试剂为浓HI.
,反应条件3所用的试剂为浓HI.