题目内容
3.如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.下列说法正确的是( )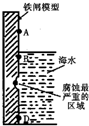
| A. | 该过程发生了析氢腐蚀 | |
| B. | 铁单质被直接氧化生成Fe3+ | |
| C. | B点附近会生成最多的铁锈 | |
| D. | 在铁闸上镶嵌一些铜片可以减缓海水对铁闸的腐蚀 |
分析 A.海水溶液为弱酸性,发生吸氧腐蚀;
B.Fe作负极失电子生成亚铁离子;
C.根据吸氧腐蚀的发生条件分析,在B处,海水与氧气接触,与Fe最易形成原电池;
D.铁闸上镶嵌一些铜片,形成的原电池中Fe作负极失电子.
解答 解:A.海水溶液为弱酸性,发生吸氧腐蚀,在酸性较强的条件下才发生析氢腐蚀,故A错误;
B.Fe作负极失电子生成亚铁离子,故B错误;
C.在B处,海水与氧气接触,与Fe最易形成原电池,发生的吸氧腐蚀的程度最大,生成铁锈最多,故C正确;
D.铁闸上镶嵌一些铜片,形成的原电池中Fe作负极失电子,可以加快海水对铁闸的腐蚀,故D错误.
故选C.
点评 本题考查了金属的电化学腐蚀,明确吸氧腐蚀发生的条件是解题的关键,题目难度不大.

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
4.下列反应中,相关坐标图错误的是( )
| A. | 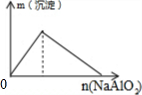 向盐酸中滴入NaAlO2溶液 | B. | 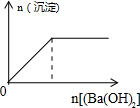 NaHSO4溶液中逐滴加入Ba(OH)2溶液 | ||
| C. | 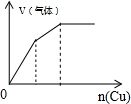 将铜粉加入到一定浓硝酸中 | D. | 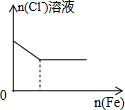 将铁粉加入到一定量氯化铁溶液中 |
14.为了适应火车提速,一些铁路线上原有的短轨需要连接为超长轨.工人常用如下反应原理来焊接钢轨:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.有关该反应的下列说法正确的( )
| A. | 该反应中铁元素的化合价降低 | B. | 该反应属于分解反应 | ||
| C. | 该反应不属于置换反应 | D. | 该反应属于化合反应 |
11.下列说法不正确的是( )
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | 氯气能使潮湿的蓝布条变为白色,说明氯气有漂白性 | |
| C. | 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L | |
| D. | 焰色反应发生的是物理变化 |
18.短周期元素X,Y,Z,W在元素周期表中对应的相应位置如图所示.已知是Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
| Y | Z | ||
| X | W |
| A. | 原子半径:X>Z>Y | B. | 气态氢化物的稳定性:X>Z | ||
| C. | Z、W均可与Mg形成离子化合物 | D. | 氧化物对应水化物的酸性:W>Y |
8.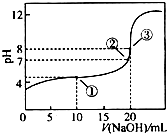 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )| A. | 该滴定过程可采用酚酞做指示剂 | |
| B. | 图中点③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| D. | 滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
15.下列有关Na2CO3 和NaHCO3的说法错误的是( )
| A. | 等质量Na2CO3 和NaHCO3分别和足量盐酸反应,相同条件下前者生成CO2少 | |
| B. | 将石灰水分别加入NaHCO3和Na2CO3 中,前者不生成沉淀 | |
| C. | 相同条件下Na2CO3 比NaHCO3更易溶于水 | |
| D. | Na2CO3 固体中含少量NaHCO3,可用加热法除去 |
12.分别用10mL1mol/LAgNO3溶液与相同体积的下述溶液恰好完全反应则下述溶液中物质的量最大的是( )
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
13.一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)═Z(g),经60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A. | 若增大压强,平衡向正方向移动,平衡常数变大 | |
| B. | 将容器体积变为20 L,Z的平衡浓度变为0.015mol/L | |
| C. | 达到平衡时X浓度为0.04 mol/L | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |