题目内容
11.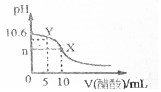 已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )
已知常温下CH3COOH和NH3•H2O的电离常数相等,现向10mL浓度为0.01mol•L-1的氨水溶液中滴加相同浓度的CH3COOH溶液,在滴加过程中溶液的pH与所加醋酸的体积关系如图所示.已知100.4=2.5.下列说法错误的是( )| A. | n=7 | |
| B. | 水的电离程度先增大再减小 | |
| C. | 常温下醋酸的电离常数约是1.67×10-5 | |
| D. | Y点溶液中c(NH3•H2O)+c(OH-)=c(CH3COO-)+c(H+) |
分析 A.当氨水与醋酸等物质的量反应生成醋酸铵时,溶液显中性;
B.酸碱抑制水的电离,醋酸铵促进水的电离;
C.0.01mol•L-1的氨水溶液中pH=10.6,根据K(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算;
D.Y点的溶质为等浓度的醋酸铵和NH3•H2O,根据物料守恒和电荷守恒分析.
解答 解:A.X点,氨水和醋酸恰好完全反应生成醋酸铵,由于铵根离子和醋酸根离子的水解程度相同,所以溶液显中性,即n=7,故A正确;
B.氨水溶液显碱性,抑制水的电离,随着醋酸的加入,生成醋酸铵,醋酸铵水解,促进水的电离,当醋酸过量,溶液显酸性时,醋酸抑制水的电离,所以水的电离程度先增大再减小,故B正确;
C.0.01mol•L-1的氨水溶液中pH=10.6,溶液中c(OH-)=10-3.4mol•L-1,则K(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-3.4}×1{0}^{-3.4}}{0.01-1{0}^{-3.4}}$=1.67×10-5,由于CH3COOH和NH3•H2O的电离常数相等,则常温下醋酸的电离常数约是1.67×10-5,故C正确;
D.Y点的溶质为等浓度的醋酸铵和NH3•H2O,溶液中物料守恒为c(NH3•H2O)+c(NH4+)=2c(CH3COOH)+2c(CH3COO-),电荷守恒为c(NH4+)+c(H+)=c(CH3COO-)+c(OH-),联立两个式子消去铵根离子的浓度可得:c(NH3•H2O)+c(OH-)=2c(CH3COOH)+c(CH3COO-)+c(H+),故D错误.
故选D.
点评 本题考查了酸碱混合时溶液定性判断及溶液酸碱性与溶液pH的关系,题目难度中等,注意掌握溶液酸碱性与溶液pH的关系,明确电荷守恒、物料守恒、电离常数的计算方法是解题的关键.

| A. | (CH3)3COH | B. | CH3OH | C. | CH3CHICH2CH3 | D. | (CH3)3C-CH2Cl |
 已知在298K和101kPa条件下,有如下反应:
已知在298K和101kPa条件下,有如下反应:反应Ⅰ:C(s)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
反应Ⅱ:2C(s)+O2(g)=2CO(g)△H2=-221kJ•mol-1
反应Ⅲ:N2(g)+O2(g)=2NO(g)△H3=+180.5kJ•mol-1
试回答下列问题:
(1)汽车尾气净化原理为反应Ⅳ:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746.5 kJ•mol-1,该反应能自发进行的条件是低温.(填“高温”、“低温”或“任意温度”).
(2)如果在一定温度下,体积为 2 升的密闭容器中发生化学反应Ⅳ,0~4min各物质物质的量的变化如下表所示:
| 物质(mol) 时间 | NO | CO | N2 | CO2 |
| 起始 | 0.40 | 1.0 | ||
| 2min 末 | 2.0 | 0.80 | 1.6 | |
| 4min 末 | 1.6 |
②试计算该温度下反应Ⅳ的化学平衡常数 K=1.6.
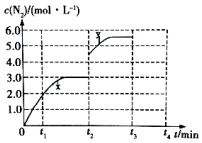
(3)若一定温度下,在容积可变的密闭容器中,上述反应Ⅳ达到平衡状态,此时容积为3L,c(N2)随时间 t 的变化曲线 x 如图所示.
①若在 t2min时改变一个条件,c(N2)随反应时间 t 的变化如曲线 y 所示,则改变的条件是快速将容器体积由3L压缩到2L.
②若在t2min时升高温度,t3min时重新达到平衡,请在图中画出在 t2~t4内 c(N2)的变化曲线.
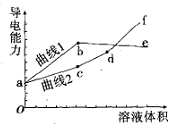 分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )
分别用浓度均为0.5mol/L的NH3•H2O和NaOH溶液,滴定20mL0.01mol/L Al2(SO4)3溶液,随滴定溶液体积的增大,溶液的导电能力变化曲线如图所示,下列说法中正确的是( )| A. | 曲线2 代表滴加NH3•H2O溶液的变化曲线 | |
| B. | b和d点对应的溶液均显碱性 | |
| C. | b点溶液中c(NH4+ )>c(SO42- )>c(H+ )>c(OH- ) | |
| D. | df段导电能力升高的原因是发生了反应Al(OH)3+OH-═[Al(OH)4]- |
| A. | 为除去酸性CuCl2溶液中含有的少量Fe3+,可在加热、搅拌的条件下加入氨水,过滤后,再向滤液中加入适量盐酸 | |
| B. | 在工业合成NH3的反应中,采取高温措施 | |
| C. | 恒温下,对平衡体系H2(g)+Br2(g)?2HBr(g)加压,可使气体颜色变深 | |
| D. | 向饱和氯化钠溶液中不断缓慢地通入HCl气体,会析出晶体 |
| A. | Sr为于第4周期ⅡA 族 | |
| B. | ${\;}_{38}^{90}$Sr核内中子数与质子数之差为14 | |
| C. | ${\;}_{38}^{90}$Sr与${\;}_{39}^{90}$Y互为同位素 | |
| D. | ${\;}_{38}^{90}$Sr的核内质子数为38,Sr元素的相对原子质量为90 |

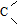 →-N=
→-N=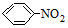 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$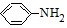 (易被氧化).请回答:
(易被氧化).请回答: ;
;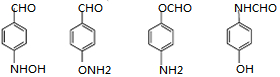 ;
;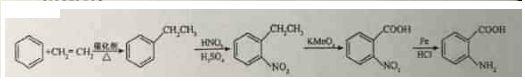 .
.