题目内容
1.近年来我国汽车拥有量呈较快增墙长趋势,NOx、CO是汽车尾气中的主要污染物,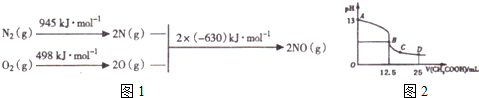
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.
分析 (1)根据能量变化图计算反应热,反应热=反应物的键能和-生成物的键能和,从而书写热化学方程式;
(2)①根据化学反应速率v=$\frac{△c}{△t}$来计算化学反应速率;根据三段式计算平衡常数;
②根据化学反应的速率和方向知识进行回答;
(3)负极上是燃料发生失电子的氧化反应,即电极反应式为:CO+O2--2e-═CO2,以石墨为电极,电解KCl溶液生成氢氧化钾、氯气和氢气,所以电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH-;根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据KOH和转移电子正极的关系式计算转移电子,再根据转移电子守恒计算CO的质量.
解答 解:(1)该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以N2和O2反应生成NO的热化学反应方程式为N2(g)+O2(g)=2NO(g)△H=+183kJ•mol-1;
故答案为:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol;
(2)①0-3s内的平均反应速率v (CO)$\frac{(2.7-1.85)×1{0}^{-3}mol/L}{3s}$=2.83×10-4mol•L-1•s-1,
2NO+2CO?N2 +2CO2
初始浓度:10×10-4 2.7×10-3mol 0 0
变化浓度:9×10-4 9×10-4 4.5×10-4 9×10-4
平衡浓度:1×10-4 1.8×10-3 4.5×10-4 9×10-4
平衡常数K=$\frac{4.5×1{0}^{-4}×(9×1{0}^{-4})^{2}}{({1×1{0}^{-4})}^{2}×(1.8×1{0}^{-3})^{2}}$=11250,
故答案为:2.83×10-4mol•L-1•s-1;11250;
②A.使用催化加快化学反应速率,所以意义很大,故错误;
B.该反应一旦发生,将在很短的时间内完成,故正确;
C.该反应达到平衡时CO、NO的转化率不相等,所以反应体系达到平时至少有一种反应物的百分含量减小,故正确;
故选:BC;
(3)负极上是燃料发生失电子的氧化反应,即电极反应式为:CO+O2--2e-═CO2,根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=$\frac{0.2mol}{2}$×2=0.2mol,燃料电池的负极反应方程式是CO+2O2--2e-=CO32-,消耗1molCO转移电子数=2mol,因此当转移0.2mol电子时消耗CO的物质的量为0.1mol,则CO的质量=0.1mol×28g/mol=2.8g,
故答案为:CO+O2--2e-═CO2;2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑;2.8.
点评 本题涉及电化学、化学反应的能量变化以及化学平衡等知识,属于综合知识的考查,难度大.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案| A. | 单质的沸点:e>d | |
| B. | 原子半径:r(e)>r(d) | |
| C. | 最高价氧化物对应水化物的酸性:c<d | |
| D. | a、b可以形成离子化合物 |
| 实验编号 | 温度/℃ | 平衡常数/mol-1•L | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | ||||
| 1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
| A. | x=1.6,y=0.2,t<6 | |
| B. | T1、T2的关系:T1>T2 | |
| C. | K1、K2的关系:K2>K1 | |
| D. | 实验1在前6 min的反应速率v (SO2)=0.2 mol•L-1•min-1 |
| A. | C0和H2混合物lmol.完全燃烧消耗O2的分子数为0.5NA | |
| B. | lmolCnH2n+2 所含的共用电子对数为(3n+l)NA | |
| C. | 标准状况下,22.4L甲醇所含的分子数目为NA | |
| D. | 高温下,33.6g Fe与足量水蒸气反应,生成的H2分子数目为0.8NA |
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
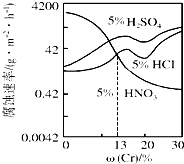 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
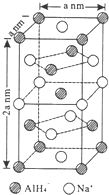 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.  .
.  .
.  (标明配位键).
(标明配位键). ,D原子的价层电子排布式为3s23p3.
,D原子的价层电子排布式为3s23p3.