题目内容
16.设NA为阿伏加德罗常数的值.下列叙述中不正确的是( )| A. | C0和H2混合物lmol.完全燃烧消耗O2的分子数为0.5NA | |
| B. | lmolCnH2n+2 所含的共用电子对数为(3n+l)NA | |
| C. | 标准状况下,22.4L甲醇所含的分子数目为NA | |
| D. | 高温下,33.6g Fe与足量水蒸气反应,生成的H2分子数目为0.8NA |
分析 A、1molCO和1mol氢气燃烧均消耗0.5mol氧气;
B、CnH2n+2中含C-H键(2n+2)条,C-C键为(n-1)条;
C、标况下甲醇为液态;
D、求出铁的物质的量,然后根据3mol铁生成4mol氢气来分析.
解答 解:A、1molCO和1mol氢气燃烧均消耗0.5mol氧气,故1molCO和氢气的混合物燃烧消耗0.5mol氧气即0.5NA个氧气分子,与两者的比例无关,故A正确;
B、CnH2n+2中含C-H键(2n+2)条,C-C键为(n-1)条,故1molCnH2n+2中含共用电子对(3n+l)NA,故B正确;
C、标况下甲醇为液态,故不能根据气体摩尔体积来计算其物质的量和分子数目,故C错误;
D、33.6g铁的物质的量为n=$\frac{33.6g}{56g/mol}$=0.6mol,而3mol铁生成4mol氢气,故0.6mol铁反应生成0.8mol氢气即0.8NA个氢气分子,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.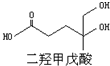 我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
 我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 二羟甲戊酸的分子式为C6H10O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物能发生银镜反应 | |
| D. | 1mol该有机物可以与足量金属钠反应产生33.6L H2 |
5.实验现象是物质性质的反映,下列对实验过程、现象、解释或由此得出的结论正确的是
| 选项 | 实验过程 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚溶液中加入Na2CO3饱和溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | 向稀苯酚溶液中加入少量稀溴水 | 未见白色沉淀 | 苯酚不与溴反应 |
| C | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 证明:乙醇具有还原性 |
| D | 将乙醇和3mol•L-1的硫酸按体积之比1:3混合共热至170℃,产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙醇发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
4.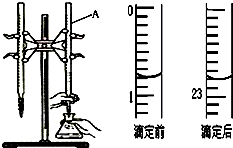 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如下表所示. 根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100 mol/L.(保留四位有效数字)
(4)若用酚酞做指示剂,判断到达滴定终点的实验现象是当溶液颜色由粉红色变为无色,且半分钟内不变色
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏高
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如下表所示. 根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100 mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏高
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
1.近年来我国汽车拥有量呈较快增墙长趋势,NOx、CO是汽车尾气中的主要污染物,
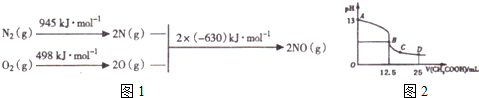
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
请回答下列问题:
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.

(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图1如下:
写出该反应的热化学方程式N2(g)+O2(g)=2NO(g)△H=+183KJ/mol
(2)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx.碳氢化合 物)进行相互反应,生成无毒物质,在某温度时,探究某种催化剂作用下反应 2NO+2CO?N2+2CO2△H<0的反应速率.用气体传感器测得不同时间的 NO和C0浓度如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) (×lO-4mol•L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO) (×lO-3mol•L-1) | 2.70 | 2.15 | 1.95 | 1.85 | 1.80 | 1.80 |
①计算以v(CO)表示0-3s内的反应速率2.83×10-4mol•L-1•s-1在该温度下反应的平衡常数K=11250L•mol-1
②对于该可逆反应,通过综合分析以上信息,至少可以说明BC(填宇母)
A.该反应使用催化意义不大
B.该反应一旦发生将在很短的时间内完成
C.该反应体系达到平时至少有一种反应物的百分含量减小
(3)C0分析仪的传感器可测定汽车尾气是否符合排放标准.该分析仪的工作原理类似于燃料电池,其中电解质是氧化钇(Y2A3)和氧化锆(ZrO2)晶体.能传导02-则负极的电极反应式为CO+O2--2e-═CO2,以该电池为电源.以石墨为电极,电解2LO.1mol•L-1KCl溶液,写出电解反应的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑,电解一段时间后.取25mL上述电解后的溶液.滴加0.21mol•L-1醋酸得到如图2曲线 (不考虑能量损失和气体溶于水,溶液体积变化忽略不计).根据图计算,上述电解过程中消耗一氧化碳的质量为2.8g.
8.生活与化学紧密联系,以下说法正确的是( )
| A. | 在医疗上碳酸钠可用于治疗胃酸过多 | |
| B. | 家用铁锅用水清洗后置于干燥处,能减缓电化学腐蚀 | |
| C. | 清洁能源所用光电池的生产材料主要是高纯度的二氧化硅 | |
| D. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 |
5.下列说法不正确的是( )
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |
6.主链上有5个碳原子,且含有2个甲基、1个乙基两个支链的烷烃有( )
| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
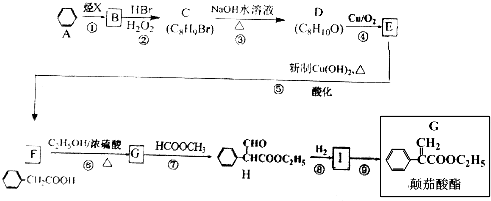
 ;
;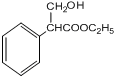 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$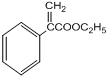 +H2O;
+H2O;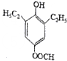 、
、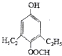
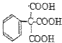 的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂自选),合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.