题目内容
14.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.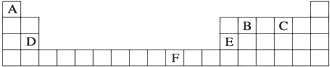
(1)B元素位于p区,F元素位于d区.
(2)A、B二种元素的原子按4:2形成的分子中含5个σ键,1个π键,B元素的原子轨道发生的是sp2杂化.
分析 (1)B为C元素,最外层电子排布为2s22p2,F为Ni元素,位于第ⅤⅢ族;
(2)A为H,B为C,按4:2形成的分子为C2H4,含4个C-H、1个C=C,以此来解答.
解答 解:(1)B为C元素,最外层电子排布为2s22p2,最后填充p电子,为p区元素;F为Ni元素,位于第ⅤⅢ族,最后填充d电子,为d区元素,
故答案为:p;d;
(2)A为H,B为C,按4:2形成的分子为C2H4,含4个C-H、1个C=C,含5个σ键,1个π键,C上没有孤对电子,成键数为3,B元素的原子轨道发生的是sp2杂化,
故答案为:5;1;sp2.
点评 本题考查原子结构及杂化,为高频考点,把握元素的位置、原子结构及化学键、杂化等为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )
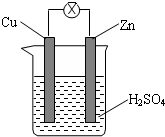

| A. | Zn是负极,发生还原反应 | |
| B. | 电子从锌片经外电路流向铜片 | |
| C. | 一段时间后溶液变蓝 | |
| D. | 铜片上可见气泡,一段时间后溶液总质量减少 |
5.某学生做如下实验:第一步,在淀粉KI溶液中滴入少量NaClO溶液,并加入少量稀硫酸,溶液立即变蓝;第二步,在上述蓝色溶液中,滴加足量的Na2SO3溶液,蓝色逐渐消失.下列对实验原理的解释和所得结论错误的是( )
| A. | 蓝色逐渐消失的原因是Na2SO3溶液具有漂白性 | |
| B. | 第一步反应的离子方程式ClO-+2I-+2H+═I2+Cl-+H2O | |
| C. | 淀粉KI溶液变蓝是因为I-被氧化为I2,I2使淀粉变蓝色 | |
| D. | 微粒的氧化性由强到弱的顺序是ClO->I2>SO${\;}_{4}^{2-}$ |
2.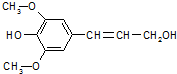 膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
 膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )
膳食纤维具有突出的保健功能,人体的“第七营养素”木质素是一种非糖类膳食纤维,其单体之一是芥子醇,结构简式如图所示.下列有关芥子醇的说法正确的是( )| A. | 不能与FeCl3溶液发生显色反应 | |
| B. | 分子中所有碳原子不可能在同一平面 | |
| C. | 分子式是C11H14O4,属于芳香族化合物 | |
| D. | 能发生氧化、取代、水解等反应 |
19.设NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA | |
| D. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
6.在强酸性溶液中,能大量共存的无色透明的离子组是( )
| A. | Al3+、Cu2+、NO3- | B. | Na+、NO3-、Fe2+ | C. | Mg2+、NH4+、Cl- | D. | Ba2+、CO32-、Cl- |
4.将铜制印刷电路板置于过量的FeCl3溶液中,下列有关该过程的描述正确的是( )
| A. | 溶液中只含Cu2+、Fe2+、Fe3+ | B. | 溶液呈蓝色 | ||
| C. | 无固体析出 | D. | 发生了置换反应 |