题目内容
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池.下列叙述正确的是( )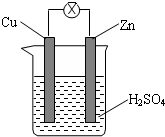
| A. | Zn是负极,发生还原反应 | |
| B. | 电子从锌片经外电路流向铜片 | |
| C. | 一段时间后溶液变蓝 | |
| D. | 铜片上可见气泡,一段时间后溶液总质量减少 |
分析 把锌片和铜片用导线相连后插入稀硫酸构成原电池,锌做负极发生氧化反应,铜做正极,溶液中氢离子在铜片上得到电子发生还原反应,依据原电池原理分析选项.
解答 解:A、原电池放电时,负极上锌失电子生成锌离子进入溶液,Zn是负极,发生氧化反应,故A错误;
B、原电池放电时,负极上失去电子发生氧化反应,正极上得电子发生还原反应,电子从负极沿导线流向正极,电子从锌片经外电路流向铜片,故B正确;
C、该原电池中,较活泼的金属锌作负极,而铜是正极未参与电极反应,所以一段时间后溶液不变蓝,故C错误;
D、铜片上氢离子得到电子生成氢气,锌和稀硫酸反应生成氢气,溶液质量增加,故D错误;
故选B.
点评 本题考查了原电池原理的分析判断,电极判断,电极名称,电极反应是解题关键,题目较简单.

练习册系列答案
相关题目
18.下列各分散质微粒中,既能透过半透膜又能透过滤纸的是( )
| A. | 氯化铁溶液 | B. | 河水 | C. | 氢氧化铁胶体 | D. | 淀粉溶液 |
19.Cl2、SO2和Na2O2都能使品红溶液褪色,下列有关说法正确的是( )
| A. | Na2O2是碱性氧化物,SO2是酸性氧化物 | |
| B. | 分别加热用Cl2、SO2和Na2O2漂白过的品红溶液都能恢复红色 | |
| C. | 将Cl2和SO2同时通入水中能生成两种强电解质 | |
| D. | Cl2、SO2和Na2O2漂白原理相同 |
12.键线式可以简明扼要的表示碳氢化合物, 种键线式物质是( )
种键线式物质是( )
 种键线式物质是( )
种键线式物质是( )| A. | 丁烯 | B. | 丙烷 | C. | 丁烷 | D. | 丙烯 |
19.氢键既可以存在于分子之间,也可以存在于分子内部的原子团之间,如邻羟基苯甲酸(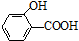 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 ( 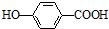 )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
 )存在分子内氢键,对羟基苯甲酸 (
)存在分子内氢键,对羟基苯甲酸 (  )存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )
)存在分子间氢键.则两者的熔点、沸点的相对大小关系是( )| A. | 前者>后者 | B. | 前者<后者 | C. | 前者=后者 | D. | 无法估计 |
9.有机化合物与人类生活水平的提高和人类社会的发展密不可分.下列对有机化合物的认识正确的是( )
| A. | 有机化合物都是共价化合物 | |
| B. | 有机化合物都含有碳、氢元素 | |
| C. | 有机化合物都具有同分异构现象 | |
| D. | 有机物种类多是由碳原子的成键特征决定的 |