题目内容
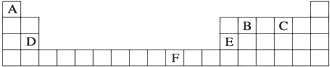
19.设NA表示阿伏加德罗常数的值.下列说法正确的是( )| A. | 标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA | |
| D. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
分析 A、标况下四氯化碳为液态;
B、求出白磷的物质的量,然后根据1mol白磷中含6molP-P键来分析;
C、氯气参加氧化还原反应后的价态不明确;
D、求出铁的物质的量,然后根据铁和盐酸反应后变为+2价来分析.
解答 解:A、标况下四氯化碳为液态,故不能根据气体摩尔体积来分析其物质的量和分子个数,故A错误;
B、12.4g白磷的物质的量为0.1mol,而1mol白磷中含6molP-P键,故0.1mol白磷中含0.6NA条P-P键,故B正确;
C、氯气参加氧化还原反应后的价态不明确,故1mol氯气反应后转移的电子数不一定是2NA个,故C错误;
D、5.6g铁的物质的量为0.1mol,而铁和盐酸反应后变为+2价,故0.1mol铁反应后失去0.2NA个电子,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.有机化合物与人类生活水平的提高和人类社会的发展密不可分.下列对有机化合物的认识正确的是( )
| A. | 有机化合物都是共价化合物 | |
| B. | 有机化合物都含有碳、氢元素 | |
| C. | 有机化合物都具有同分异构现象 | |
| D. | 有机物种类多是由碳原子的成键特征决定的 |
7.用括号中的试剂除去各组中的杂质,正确的是( )
| A. | 苯中的甲苯(溴水) | B. | 溴苯中的溴(苯) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 95.6%乙醇中的水(CaO) |
4.下列说法正确的是( )
| A. | 1 mo1•L-1NaCl溶液中含有1 mol Na+ | |
| B. | 1 mol O2的质量是32 g | |
| C. | 1 mol氢气的体积约为22.4 L | |
| D. | 标准状况下,11.2 L CH4含有10 mol电子 |
11.如图各装置中,夹紧①、③、④中的弹簧夹,并作相关操作,会漏气的装置是 ( )
| A. | 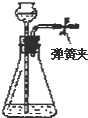 长颈漏斗内液面高度保持不变 | |
| B. | 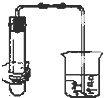 双手移去后.导管中水面与烧杯水面相平 | |
| C. | 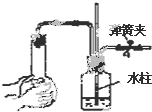 长导管内形成一段水柱 | |
| D. | 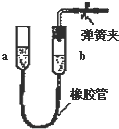 上移a管后,a、b两端液面形成了一段稳定的高度差 |
8.用下列实验装置进行相应实验,能达到实验目的是( )
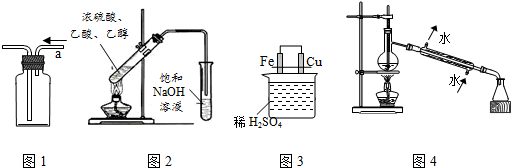

| A. | 用图1所示装置从a口进气可收集CH2=CH2 | |
| B. | 用图2所示装置制取并收集乙酸乙酯 | |
| C. | 用图3所示装置比较Fe、Cu的金属活动性 | |
| D. | 用图4所示装置进行石油的蒸馏实验 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温下,14g CO和N2的混合物含的原子数为NA | |
| B. | 1mol Fe发生氧化反应失去的电子数一定是3NA | |
| C. | 0.1mol•L-1 NaCl溶液中含的Cl-数是0.1NA | |
| D. | 0.1mol H2SO4与1L 0.1mol•L-1 NaOH溶液反应,生成的H2O分子数是0.2NA |
 Ⅰ.按图装置进行实验,并回答下列问题.
Ⅰ.按图装置进行实验,并回答下列问题. Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.
Ⅱ.(1)电工经常说的一句口头禅:“铜接铝,瞎糊弄”,所以电工操作上规定不能把铜导线与铝导线连接在一起使用,说明原因:铜与铝连接会构成原电池,其中铝为原电池的负极,铜为原电池的正极.构成原电池后,铝的腐蚀速度大大加快,电阻增大,放热增多,时间长了,有可能引发火灾.