题目内容
12.向含有1molFeCl2的溶液中通入0.2molCl2,再加入含0.1molX2O72-的酸性溶液,使溶液中Fe2+恰好全部被氧化为Fe3+,并使X2O72-还原为X3+,则n值为( )| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
分析 1mol的FeCl2 完全被氧化成铁离子失去1mol电子,X2O72-中X的化合价为+6,根据氧化还原反应中得失电子相等计算出X的化合价及n的数值.
解答 解:0.2mol Cl2完全反应变成氯离子得到电子的物质的量为:0.2mol×2=0.4mol;Xn+的化合价为+n,X2O72-中X的化合价为+6,0.1mol X2O72-则完全反应得到电子的物质的量为:(6-n)×2×0.1mol=0.2(6-n)mol;1mol的FeCl2完全被氧化成铁离子失去1mol电子,根据电子守恒可得:0.4mol+0.2(6-n)mol=1mol,
解得:n=3,
故选B.
点评 本题考查了氧化还原反应的实质及相关计算,题目难度中等,注意掌握氧化还原反应中电子守恒在化学计算中的应用方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
2.下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )
| A. | 石灰石 | B. | Ca(OH)2 | C. | CaCO3 | D. | CH4 |
3.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸充分反应,其中( )
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |
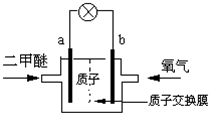 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域.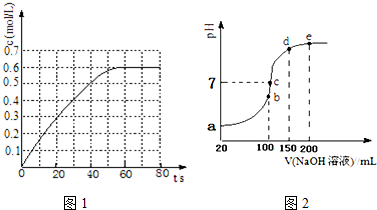
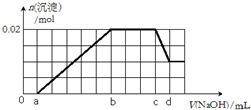 有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
有一未知的无色溶液,可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Fe3+、Al3+,NO3-、CO32-、SO42-,现取两份100mL溶液进行如下实验: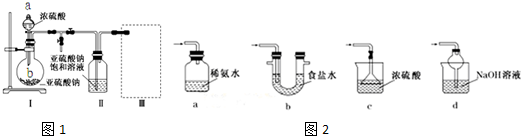


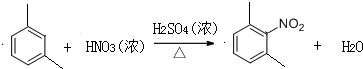 ,反应类型为取代反应或硝化反应;
,反应类型为取代反应或硝化反应;
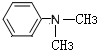 (写结构简式).
(写结构简式).