题目内容
14.金属在自然界中大多以化合态形式存在,但它们在日常生活中应用比较广泛,需要进行冶炼.(1)铝热反应常用来冶炼某些难熔金属,下列物质中,不能发生铝热反应的是MgO(填标号).
a.CuO b.MgO c.Fe304 d.MnO2
(2)金属鲤常用于制备电池,北斗卫星采用磷酸铁钾(LiFepO4)电池,已知LiFepO4新型锂离子动力电池放电时总反应式为FePO4+Li═LiFepO4
①该电池的正极反应式为FePO4+Li++e-═LiFePO4,电池内部Li+向正极移动.
②维持电流强度为5A,电池工作10分钟,理论上消耗锂约为0.22g(保留两位小数,已知F=96500C•mol-1)
③该电池的电解质溶液能否用水配制?(填“能”或“不能”),原因是因为电解材料锂与水反应生成氢气.
分析 (1)铝热反应可冶炼熔点高的活泼性比Al弱的金属,以此来解答;
(2)①放电时,正极上FePO4得电子发生还原反应,电极反应式为:FePO4+Li++e-═LiFePO4,原电池中阳离子向正极移动;
②持电流强度为5A,电池工作10分钟,则电量为5A×600s=3000C,转移电子的物质的量为$\frac{3000C}{96500C/mol}$,以此计算消耗锂的质量;
③该电池的电解质溶液不能水用配制,因为电解材料锂与水反应.
解答 解:(1)铝热反应可冶炼熔点高的活泼性比Al弱的金属,由金属活泼性可知,只有Mg的金属性大于Al,而a、c、d中金属的活泼性小于Al,则只有b不能与铝粉发生铝热反应,故答案为:MgO;
(2)①放电时,正极上FePO4得电子发生还原反应,电极反应式为:FePO4+Li++e-═LiFePO4,原电池中阳离子向正极移动,故答案为:FePO4+Li++e-═LiFePO4;正;
②持持电流强度为5A,电池工作10分钟,则电量为5A×600s=3000C,转移电子的物质的量为$\frac{3000C}{96500C/mol}$,则消耗锂的质量为$\frac{3000C}{96500C/mol}$×6.941 g/mol=0.22g,
故答案为:0.22;
③该电池的电解质溶液不能水用配制,因为电解材料锂与水反应,故答案为:不能,因为电解材料锂与水反应生成氢气.
点评 本题考查化学电源新型电池知识,本题难度不大,注意根据电池反应书写电极反应式的方法,以及离子的定向移动问题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.在溶液中进行的反应,下列因素中对化学反应速率不产生明显影响的是( )
| A. | 温度 | B. | 压强 | C. | 浓度 | D. | 催化剂 |
19.下列诸因素中,可以解释水的熔、沸点比氯化钠低的是( )
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |
5.下列离子方程式书写正确的是( )
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
2.下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )
| A. | 石灰石 | B. | Ca(OH)2 | C. | CaCO3 | D. | CH4 |
3.等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸充分反应,其中( )
| A. | Na2CO3放出的CO2多 | B. | NaHCO3放出的CO2多 | ||
| C. | Na2CO3放出CO2的速率快 | D. | NaHCO3放出CO2的速率快 |


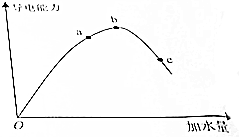 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答: