题目内容
2.已知Ksp(AgCl)=1.8×10-10,若向50mL 0.018mol•L-1的AgNO3溶液中加入50mL 0.020mol•L-1的盐酸(不考虑混合后溶液体积的变化).计算:
(1)混合溶液的pH.
(2)混合后溶液中的Ag+浓度.
分析 (1)混合前后氢离子不变,结合c=$\frac{n}{V}$、pH=-lgc(H+)计算;
(2)先计算混合后剩余的Cl-,结合Ksp计算Ag+浓度.
解答 解:(1)混合液中c(H+)=$\frac{0.05L×0.02mol/L}{0.1L}$=0.01 mol•L-1,pH=-lg10-2=2,
答:混合溶液的pH为2;
(2)混合后溶液中剩余Cl-的浓度为c(Cl-)=$\frac{0.05L×0.02mol/L-0.05L×0.018mol/L}{0.1L}$=1×10-3mol•L-1,c(Ag+)=$\frac{Ksp}{c(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{1×1{0}^{-3}}$=1.8×10-7mol•L-1,
答:混合后溶液中的Ag+浓度为1.8×10-7mol•L-1.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握离子浓度、Ksp的关系为解答的关键,侧重分析与计算能力的考查,注意混合后过量判断,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
15.已知高炉炼铁的化学方程式为Fe2O3+3CO=2Fe+3CO2【注:高温条件】下列对该反应的叙述不正确的是( )
| A. | CO是还原剂 | B. | Fe2O3被还原 | ||
| C. | 属于氧化还原反应 | D. | 属于置换反应 |
16.下列有机物分子中,所有原子一定处于同一平面的是( )
| A. | CH3-CH═CH2 | B. |  | C. | CH3-CH3 | D. |  |
13.下列各组在溶液中的反应,无论谁过量,都可以用同一离子方程式表示的是( )
| A. | Ba(OH)2与NaHSO4 | B. | Ba(OH)2与H2SO4 | ||
| C. | 石灰水和二氧化碳 | D. | Ca(HCO3)2与NaOH |
20.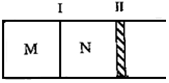 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
 如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )
如图所示隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生如下反应:A(g)+3B(g)?2C(g)△H=-192kJ•mol-1.初始M、N容积相同,保持温度不变,向M、N中分别通入x mol A和y mol B的混合气体.下列说法不正确的是( )| A. | 若平衡时A气体在两容器中的体积分数相等,则x一定等于y | |
| B. | 若x:y=1:2,则平衡时,M中的转化率:A<B | |
| C. | 若x:y=1:3,当M中放出热量172.8 kJ时,A的转化率为90% | |
| D. | 若x=1.4,y=1,N中达到平衡时体积为2L,C为0.4mol,则反应起始时M的体积为2.4L |
11. 25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
 25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )| A. | 曲线a表示PbCO3 | |
| B. | 以PbSO4、Na2CO3和焦炭为原料可制备Pb | |
| C. | 当PbSO4和PbCO3沉淀共存时,溶液中$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=105 | |
| D. | 向X点对应的饱和溶液中加入少量Pb(NO3)2,可转化为Y点对应的溶液 |
12.一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时,已知数据如表所示:
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的溶液的说法,比较合理的( )
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
| A. | 向该混合溶液中加入少量铁粉即能观察到红色固体析出 | |
| B. | 向该混合溶液中逐滴加入NaOH溶液,最先看到蓝色沉淀 | |
| C. | 该混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4 | |
| D. | 向该混合溶液中加入适量氯水,并调节pH为3~4,然后过滤,可得到纯净的CuSO4溶液 |