题目内容
15.已知高炉炼铁的化学方程式为Fe2O3+3CO=2Fe+3CO2【注:高温条件】下列对该反应的叙述不正确的是( )| A. | CO是还原剂 | B. | Fe2O3被还原 | ||
| C. | 属于氧化还原反应 | D. | 属于置换反应 |
分析 Fe2O3+3CO=2Fe+3CO2,该反应中Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,
A.失电子化合价升高的反应物是还原剂;
B.得电子化合价降低的反应物是氧化剂,氧化剂被还原;
C.有化合价变化的反应属于氧化还原反应;
D.一种单质和一种化合物反应生成另外的单质和化合物的反应为置换反应.
解答 解:A.失电子化合价升高的反应物是还原剂,C元素化合价由+2价变为+4价,则CO是还原剂,故A正确;
B.得电子化合价降低的反应物是氧化剂,氧化剂被还原,Fe元素化合价由+3价变为0价,Fe2O3是氧化剂,在反应中被还原,故B正确;
C.Fe2O3+3CO=2Fe+3CO2,该反应中Fe元素化合价由+3价变为0价、C元素化合价由+2价变为+4价,则属于氧化还原反应,故C正确;
D.一种单质和一种化合物反应生成另外的单质和化合物的反应为置换反应,该反应中反应物都是化合物,所以该反应不是置换反应,故D错误;
故选D.
点评 本题考查氧化还原反应,为高频考点,侧重考查基本概念、反应类型判断,明确基本概念内涵是解本题关键,知道常见元素化合价,题目难度不大.

练习册系列答案
相关题目
5. N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用
Ⅰ.CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如表:
(1)写出光气(COCl2)的电子式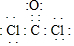
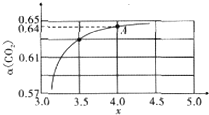
(2)图1是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况.用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kj/mol、726.83kj/mol、285.2kj/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH).
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用Ⅰ.CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)反应过程中测定的部分数据如表:
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
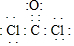
(2)图1是T℃时,CO和Cl2的物质的量浓度随时间(t)的变化情况.用COCl2表示2min内的反应速率v(COCl2)=0.1mol/(L.min).该温度下的平衡常数K=5.
(3)在一容积可变的密闭容器中充入10molCO和20molCl2,CO的平衡转化率随温度(T)、压强(P)的变化如图1所示.
①下列说法能判断该反应达到化学平衡的是BD(填字母序号).
A.Cl2的消耗速率等于COCl2的生成速率
B.Cl2的体积分数不变
C.Cl2的转化率和CO的转化率相等
D.混合气体的平均摩尔质量不再改变
②比较A、B两点压强大小:P(A)<P(B)(填“>”、“<”或“=”)
③若达到化学平衡状态A时,容器的体积为20L.如果反应开始时仍充入10molCO和20molCl2,则在平衡状态B时容器的体积为4L.
Ⅱ甲醇是一种重要的化工原料,查资料,甲醇的制取可用以下两种方法:
(1)可用CO和H2制取甲醇:
已知CO、CH3OH和H2的燃烧分别是283kj/mol、726.83kj/mol、285.2kj/mol写出由 CO和H2制取甲醇的热化学方程式CO(g)+2H2(g)=CH3OH(l),△H=-126.57kJ/mol.
(2)用电化学法制取:某模拟植物光合作用的电化学装置如图2,该装置能将H2O和CO2转化为O2和甲醇(CH3OH).
①该装置工作时H+向b区移动(填“a”或“b”)
②b极上的电极反应式为6H++CO2+6e-=CH3OH+H2O.
7.化学是一门实用性的学科,以下叙述正确的是( )
| A. | 静置后的淘米水能产生丁达尔现象,这种“淘米水”是胶体 | |
| B. | “洁厕灵”有效成分为盐酸,与漂白粉混合使用效果更佳 | |
| C. | 新型能源生物柴油和矿物油主要化学成分相同 | |
| D. | 铝热反应中可得到铁,工业上可以利用该反应来大量生产铁 |
4.在100℃时,将0.200mol的四氧化二氮气体充入2L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如表格:?
试填空:?
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3、a=b(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=0.070mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为0.015mol/(L•min).
(3)100℃时,该反应的平衡常数K=0.36
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
 | 0 | 2 | 4 | 6 | 8 | 10 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应达到平衡时,四氧化二氮的转化率为60%,表中c2>c3、a=b(填“>”、“<”或“=”).
(2)2min时四氧化二氮的浓度c1=0.070mol/L,在0~2min时间段内,四氧化二氮的平均反应速率为0.015mol/(L•min).
(3)100℃时,该反应的平衡常数K=0.36
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是0.200mol/L.
 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.



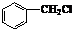
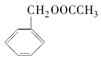 )是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图:
)是其中的一种,它可以从茉莉花中提取,也可以用乙烯和甲苯为原料进行人工合成.其中一种合成路线如图: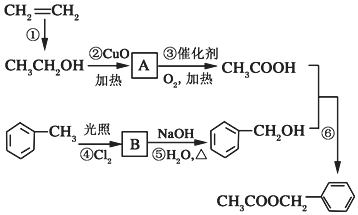
 ;
;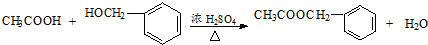 ;
;